
化学与生活、社会发展息息相关,下列有关说法不正确的是
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:2016届河南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
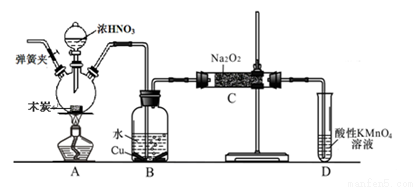
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高一上期中考试化学试卷(解析版) 题型:选择题
将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A.4(b-2a)mol/L B.20(2a-b)mol/L
C.20(b-2a)mol/L D.10(b-a)mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016安徽蚌埠第二中学高二上学期期中考试化学试卷(解析版) 题型:选择题
下列变化中,属于化学变化的是( )
①橡胶的老化②油脂的硬化 ③石油的裂化 ④蛋白质的盐析
A.①②③④B.只有②③C.只有①③D.只有①②③
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列溶液可能大量共存的离子组是( )
 A.含有大量S2—的溶液:Na+、C1O—、C1—、CO32—
A.含有大量S2—的溶液:Na+、C1O—、C1—、CO32—
B.含有大量Fe3+的溶液:K+、Na+、A1O2—、SO42—
C.能使pH试纸变红的溶液:NH4+、Na+、NO3—、HCO3—
D.水电离产生的c(H+)=1×10—12mol·L—1的溶液:Mg2+、SO42—、NO3—、C1—
查看答案和解析>>
科目:高中化学 来源:2016届辽宁沈阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质转化在给定条件下能实现的是( )
① 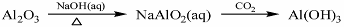
② 
③ 
④ 
A.①③ B.③④ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源:2016届湖南师范大学附属中学高三上月考(四)化学试卷(解析版) 题型:简答题
(12分) ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。但二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。
(1)欧洲国家主要采用氯酸钠氧化浓盐酸制备ClO2,缺点主要是产率低,产品难以分离,还产生毒副产品。该反应的化学反应方程式为: 。科学家又研究出了一 种新的制备ClO2的方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
(2)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2 S2 O3溶液.(已知:2S2O32-+I2=S4O62-+2I-)
III.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示。
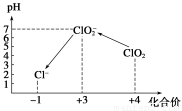
请回答:
①操作I中反应的离子方程式是 。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式 是 。
是 。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10一3mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是 mg/L。
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4 2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
时间/s | 0 | 20 | 4 | 60 | 80 | 100 |
c(NO2)/mol·L | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是( )
A.升高温度该反应的平衡常数K减小
B.20~40 s 内,v(N2O4)=0.004 mol·L-1·s1
C.反应达平衡时,吸收的热量为0.30 Q kJ
D.100 s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏石嘴山第三中学高二上期中考试化学卷(解析版) 题型:选择题
分子式为C4H10O并能与金属钠反应放出H2的有机化合物有( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com