
| A. | HBr和CO2 | B. | NH3和NH4Cl | C. | KOH和NaCl | D. | H2SO4和Na2SO4 |
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的本质是有化合价的升降 | |
| B. | 据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| C. | 向醋酸溶液中加入少量氢氧化钠溶液,由于发生中和反应,溶液的导电能力降低 | |
| D. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛、甲酸、甲酸甲酯和乙醇都能使酸性高锰酸钾溶液褪色 | |
| B. | 相同条件,等物质的量的乙醇、乙二醇、丙三醇中分别加入足量的金属钠产生氢气的体积之比是2:3:6 | |
| C. | 苯酚和乙醛都可以使溴水褪色,但发生的反应类型不同 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
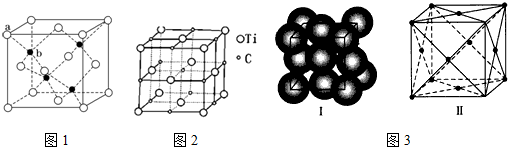
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com