
现有一试管NO2,某同学设计如下表实验,以尽可能多地使NO2被水吸收。
⑴请完成下表:
| 实验步骤 | 实验现象 | 解释(用化学方程式表示) | |
| ① | 将充满NO2的倒立在盛有水的水槽中,拨去橡皮塞,轻轻晃动试管。 | 试管内气体由 色逐渐变为无色,液面上升至试管高度的 (离管口)处。 | |
| ② | | | |
| ③ | 重复步骤②的操作数次,直至液体充满整个试管。 | 试管内充满无色液体。 | 总反应方程式: |

实验步骤 实验现象 解释(用化学方程式表示) ① 红棕(2分) 2/3(2分) 3NO2+H2O=2HNO3+NO(2分) ② 当试管中液面不再上升时,通过导管缓缓通入少量O2,轻轻晃动试管。
(2分)当通入O2时,试管内气体迅速由无色变成红棕色,液面继续上升,气体又逐渐变为无色。(2分) 2NO+ O2=2NO2
3NO2+H2O=2HNO3+NO(2分)③ 4NO2+O2+2H2O=4HNO3(2分)
⑵ (2分)
(2分)
解析试题分析:①将充满NO2的倒立在盛有水的水槽中,拨去橡皮塞,轻轻晃动试管,由于发生反应:3NO2+ H2O == 2HNO3+ NO ,所以气体会有红棕色变为无色,根据方程式中气体的物质的量的关系可知:液面上升至试管高度的2/3。②当试管中液面不再上升时,通过导管缓缓通入少量O2,轻轻晃动试管,此时在试管内会发生反应:2NO+ O2=2NO2; 3NO2+H2O=2HNO3+NO,所以试管内气体迅速由无色变成红棕色,液面继续上升,气体又逐渐变为无色。③重复步骤②的操作数次,直至液体充满整个试管,试管内充满无色液体将上述两个方程式叠加,就可以得到总方程式是:4NO2+O2+2H2O=4HNO3。⑵此实验的装置简图是 。
。
考点:考查NO2气体被氧气吸收的知识。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:填空题
已知A经如右图所示的过程转化为D, 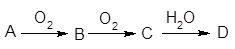
请回答下列问题:
(1)若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是 。
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境。某工厂净化残余的B气体装置如图,则除去B气体的总反应方程式是 。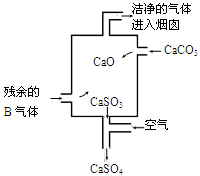
(2)若A是能使酚酞试液变红的气体。D是一种强酸。写出A→B的化学方程式 ;工业生产上,以34吨A为原料,最多可以生产63%的D酸 吨。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
普通玻璃中,Na2SiO3、CaSiO3、SiO2的物质的量之比是Na2SiO3∶CaSiO3∶SiO2=1∶1∶4。
(1)若以aNa2O·bCaO·mSiO2形式表示此玻璃的组成,则a∶b∶m=____________。
(2)若要制备1 000 kg上述玻璃,需要原料各多少千克?共可产生标准状况下的CO2气体多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。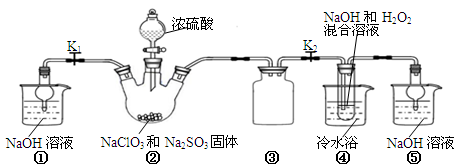
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6) 样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组为制备消毒液(主要成分是NaClO),设计了下列装置,并查阅到下列资料:在加热情况下氯气和碱溶液能发生如下反应:
3Cl2 + 6OH﹣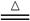 5Cl﹣+ ClO3﹣+3H2O
5Cl﹣+ ClO3﹣+3H2O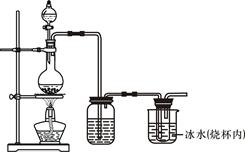
饱和食盐水 氢氧化钠溶液(试管内)
请回答下列问题:
(1)连接好装置,装药品之前,必须进行的一项操作步骤是________________。
(2)圆底烧瓶内发生反应的化学方程式为___________________________;大试管内发生反应的离子方程式为__________________________________________。
(3)饱和食盐水的作用是_______;冰水的作用是___________________。
(4)在制取Cl2时,实验室中若无MnO2,可用KMnO4粉末代替,发生下列反应:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O, 则可选择的发生装置是(填序号)___________。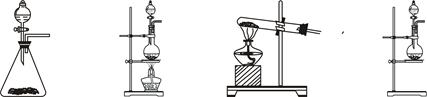
a、 b、 c、 d、
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。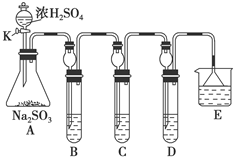
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入 ______ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(18分)I.实验室制备、收集干燥的SO2,所需仪器如下。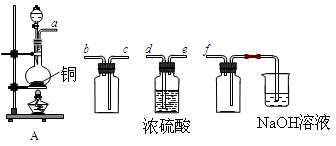
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: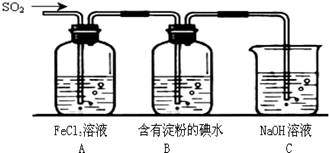
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 ;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com