
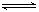 2C(g) ?H <0,下列叙述错误的是
2C(g) ?H <0,下列叙述错误的是| A.升高温度v(正)、v(逆)都增大,但v(逆)增的更大 |
| B.增大压强v(正)、v(逆)都增大,但v(正)增的更大 |
| C.增大A的浓度v(正)会增大,但v(逆)会减小 |
| D.采用正的催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g);△H<0。当分离出NH3后下列说法正确的是
2NH3(g);△H<0。当分离出NH3后下列说法正确的是| A.平衡向逆向移动 | B.平衡不移动 |
| C.正反应速率先变大后变小 | D.逆反应速率先变小后变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)在密闭容器中进行,下列情况中,不能使化学反应速率加快的是
C(g)在密闭容器中进行,下列情况中,不能使化学反应速率加快的是 | A.升高温度 | B.增加A的物质的量 |
| C.使用高效催化剂 | D.将A由块状变成粉末状 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Z+R的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是()
Z+R的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是() 
| A.减少Z物质 | B.加大压强 | C.升高温度 | D.使用催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) ΔH<0的正反应速率随时间的变化情况,试根据此曲线判断说法可能正确的是( )
2SO3(g) ΔH<0的正反应速率随时间的变化情况,试根据此曲线判断说法可能正确的是( )
| A.t1时降低温度,平衡向正反应方向移动 |
| B.t1 时减小压强,平衡向逆反应方向移动 |
| C.t1时减小SO2的浓度,增加了SO3的浓度 |
| D.t1时增加SO2和O2的浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
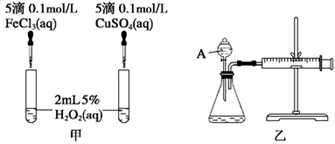
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com