
| A. | 熔融的氢氧化钠 | B. | 硝酸钾溶液 | C. | 硫酸铜晶体 | D. | 无水乙醇 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的摩尔质量为17g | |
| B. | 48gO3含有的臭氧分子数为6.02×1023 | |
| C. | 1mol•L-1NaCl溶液中含1molNa+ | |
| D. | 标准状况下,1molH2O的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水银不是银,而是金属汞 | B. | 纯碱不是碱,而是盐 | ||
| C. | 干冰不是冰,而是固体二氧化碳 | D. | 烧碱不是碱,而是一种常见的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
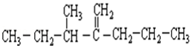 名称为3-甲基-2-丙基-1-戊烯.
名称为3-甲基-2-丙基-1-戊烯.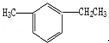 名称为1-甲基-3-乙基苯.
名称为1-甲基-3-乙基苯. 名称为:2,4-二甲基-3-乙基戊烷.
名称为:2,4-二甲基-3-乙基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 炼铁是铁矿石在高温下被氧化的过程 | |
| D. | 钴的制备:3Co3O4+8Al$\stackrel{高温}{→}$9Co+4Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.完成下列填空:
碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径和离子半径均减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 非金属气态氢化物稳定性逐渐增强 | |
| D. | 单质的熔点降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程只有O2生成,共6.72 L的气体(标况) | |
| B. | 本过程一共涉及了三个化学反应 | |
| C. | 最终得到氢氧化铝的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=0.15 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com