
科目:高中化学 来源:不详 题型:单选题
| A.三者浓度相同时,pH大小顺序为③>②>① |
| B.三者浓度相同时,稀释相同倍数,pH变化最大的为② |
| C.三者的pH均为9时,物质的量浓度的大小关系为③>②>① |
| D.三者浓度相同时,分别加入同体积同浓度的盐酸后,pH最大的是① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
A.挥 发性 发性 | B.酸性比碳酸强 | C.难电 离 离 | D.易溶于水 |

 的比值 (填“增大”、“减小”或“不变”)。
的比值 (填“增大”、“减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8╳10-9 | 3.7╳10-15 | K1=4.3╳10-7 K2=5.6╳10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
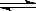 CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )
CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )| A.NH4Cl固体 | B.CH3COONa | C.NH3·H2O | D.Zn粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过测浓度均为0.01 mol/L的溶液的pH大小来鉴别盐酸和乙酸? |
| B.向均含石蕊的盐酸和乙酸溶液中分别加入NaCl、CH3COONa来鉴别盐酸和乙酸是否为弱电解质? |
| C.加热蒸发FeCl3溶液制备FeCl3晶体? |
| D.测均为0.1 mol/L的NaCl、CH3COONa溶液的pH来鉴别盐酸和乙酸是否为弱电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质的量浓度相同 | B.氢氧根离子浓度相同 |
| C.pH相同 | D.溶液中离子浓度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com