
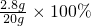 =14%,故答案为:14%.
=14%,故答案为:14%.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省淄博市高三复习阶段性检测(二模)理科综合化学试卷(解析版) 题型:填空题
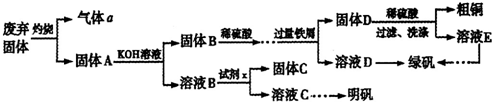
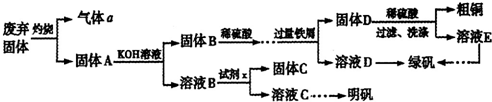
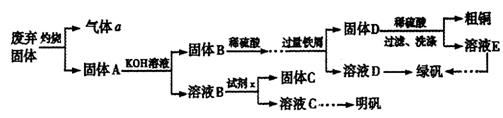
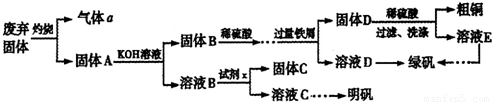
实验室模拟用工业废弃固体(含有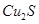 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(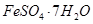 )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下:
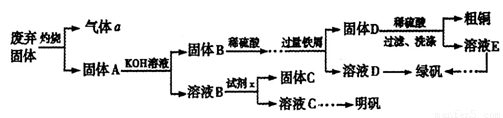
(1)试剂x是_________(写化学式)。
(2)配平下列方程式:
____
(4)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0g样品配成100mL溶液,移取25.00mL用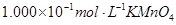 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO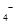 被还原为
被还原为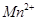 )。
)。
请回答下列问题:
①滴定时,KmnO4标准溶液应盛放在______________(填仪器名称)中。
②若达到滴定终点消耗KmnO4标准溶液体积为25.00mL,则该产品中铁元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟用工业废弃固体(含有![]() 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(![]() )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2![]() 12H2O]的操作流程如下:
12H2O]的操作流程如下:
(1)试剂x是_________(写化学式)。
(2)配平下列方程式:
____![]()
(4)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0g样品配成100mL溶液,移取25.00mL用![]() 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO![]() 被还原为
被还原为![]() )。
)。
请回答下列问题:
①滴定时,KmnO4标准溶液应盛放在______________(填仪器名称)中。
②若达到滴定终点消耗KmnO4标准溶液体积为25.00mL,则该产品中铁元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2013年山东省淄博市高考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com