
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)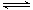 TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
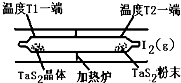
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
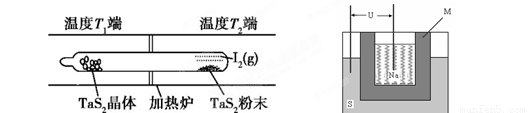
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________ ,Na2S溶液中c(H+)+ c(Na+)=________________。
(1)80%(2分)(2)>(1分); I2(2分)(3)xS+2e-=Sx2-(2分);离子导电(2分)
(4)S2-+H2O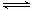 HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O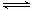 H2S+OH-(2分,只写第一步也可得分)
H2S+OH-(2分,只写第一步也可得分)
c(HS-)+2c(S2-)+c(OH-) (2分)
【解析】
试题分析:(1) TaS2(s)+2I2(g)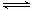 TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始量(mol) 1 0 0
转化量(mol) 2x x x
平衡量(mol) 1-2x x x
由于反应前后体积不变,因此可以用物质的量代替物质的量浓度表示其平衡常数,即
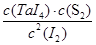 =4=
=4=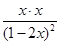
解得x=0.4
所以I2(g)的平衡转化率为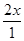 ×100%=80%
×100%=80%
(2)加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,这说明低温有利于TaS2晶体的生成,因此逆反应是放热反应,则正方应是吸热反应,即△H>0;先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),而最后又产生单质碘,因此单质碘是可以循环的物质。
(3)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式2Na + xS=Na2Sx可知,钠是还原剂,做负极,S单质是氧化剂,在正极得到电子,因此正极反应式为xS+2e-=Sx2-。在熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,因此另外一种作用是离子导电。
(4)硫化钠是强碱弱酸盐,S2-水解溶液显碱性,因此Na2S溶液水解的离子方程式为S2-+H2O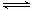 HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O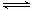 H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
考点:考查平衡常数的应用、外界条件对平衡状态的影响、原电池的应用与判断以及水解方程式的书写和溶液中离子浓度关系判断


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
| c(H2SO3) | c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)![]() TaI4(g)+S2(g)△H﹥0 (I)
TaI4(g)+S2(g)△H﹥0 (I)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为
 (2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为
(4)25℃时,H2SO3 ![]() HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中![]() 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版) 题型:填空题
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。

回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷解析版) 题型:填空题
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。

(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 ,
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中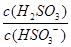 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com