
| A. | 500 mL1 mol/L MgCl2溶液中含有Cl-数目为0.5NA | |
| B. | 标准状况下,33.6L SO3与48gO2所占的体积相等 | |
| C. | 17 gNH3含有的电子个数为l0NA | |
| D. | 1 mol O2与2 mol SO2一定条件下混合反应,可生成2 mol SO3 |
分析 A.n(MgCl2)=c•V,含有n(Cl-)=2n(MgCl2),N(Cl-)=n(Cl-)×NA;
B.n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算48gO2所占的体积;
C.1个NH3含10个电子;
D.2SO2+O2?2SO3,可逆反应不能进行到底.
解答 解:A.n(MgCl2)=1mol/L×0.5L=0.5mol,含有n(Cl-)=2n(MgCl2)=2×0.5mol=1mol,N(Cl-)=1mol×NAmol-1=NA,故A错误;
B.n(O2)=$\frac{48g}{32g/mol}$=1.5mol,标准状况下的体积V=1.5mol×22.4L/mol=33.6L,故B正确;
C.17g NH3是1mol,1molNH3含10mol电子,所以含有的电子个数为l0NA,故C正确;
D.2SO2+O2?2SO3,可逆反应不能进行到底,因此生成的SO3小于2mol,故D错误;
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,其中B为易错点,容易犯经验主义错误,注意以物质的量为中心的公式的应用.


科目:高中化学 来源: 题型:选择题
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
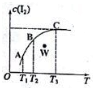 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )| A. | 正反应为吸热反应 | B. | 平衡常数:KA>KB | ||
| C. | 反应速率:vB>vC | D. | W点时,v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀镍时,Ni为阴极,镀件为阳极 | |
| B. | 电镀和化学镀原理都是利用氧化还原反应 | |
| C. | 化学镀无需通电,对镀件的导电性无特殊要求 | |
| D. | 化学镀中H2PO2-中P化合价为+1,有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
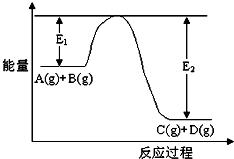 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com