
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
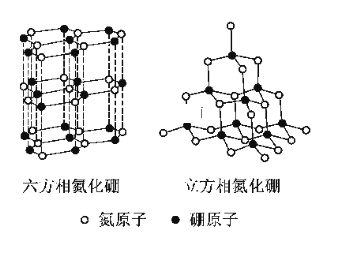
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中的B原子的杂化类型相同
D. 两种晶体均为分子晶体
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是

A. 阳极的电极反应式为2H2O-4e-![]() 4H++O2↑
4H++O2↑
B. 产品室中发生的离子反应为HPO32-+2H+![]() H3PO3
H3PO3
C. 原料室中Na+浓度保持不变
D. 阴极室中溶液的pH逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
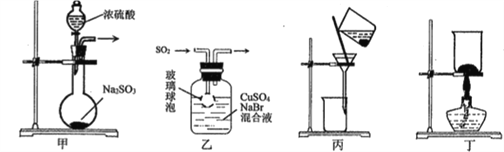
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按图1所示工艺流程制备氯化铜晶体(CuCl2·2H2O):
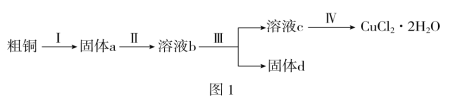
请回答下列问题:
(1)为了完成步骤Ⅰ,可采用图2所示的装置将粗铜完全转化为固体a:
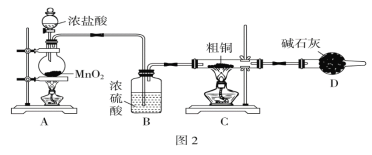
①A装置中发生反应的离子方程式是___________________________________________。
②在该实验中,点燃A、C装置中的酒精灯时,应该先点燃________装置的酒精灯,D装置的作用是_____________________________,C装置中生成的产物是________________。
③有同学认为应在B装置前增加吸收HCl的装置,你认为是否必要____(填“是”或“否”)。
(2)步骤Ⅱ的操作:将固体a置于烧杯中,然后加入_________,至固体完全溶解。
(3)步骤Ⅲ中应先加入某试剂调节溶液b的pH以除去杂质,该试剂可选用下列试剂中的________(填序号)。
a.NaOH溶液 b.氨水 c.CuO d.Cu2(OH)2CO3 e.CuSO4溶液
(4)步骤Ⅳ中,将溶液c蒸发浓缩、冷却结晶、过滤得到CuCl2·2H2O。现欲得到无水CuCl2,在实验室也可以采用图2所示装置使CuCl2·2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是___________________________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化,能通过一步化学反应完成的是( )
A.Al→Al(OH)3B.Fe→FeCl2C.SiO2→Na2SiO3D.SiO2→H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸦片具有复杂的组成,其中的罂粟碱的分子结构如图。鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短。已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是
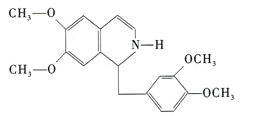
A. 23.75 mol;5 B. 24.5 mol;7 C. 24.5 mol;8 D. 23.75 mol;4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是____。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是____mol/(Lmin);10秒末NH3的浓度是___mol/L;N2 的的物质的量___mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
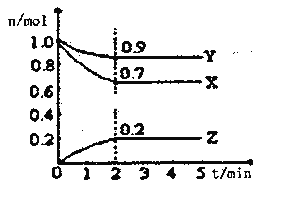
(1)该反应的化学方程式为___________
(2)从开始至2min,Z的平均反应速率为____________;
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量. E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温恒容的密闭容器中充入H2(g)和I2(g)各0.1mol,发生反应H2(g)+I2(g)![]() 2HI(g),该反应的能量变化如图所示。下列说法正确的是( )
2HI(g),该反应的能量变化如图所示。下列说法正确的是( )
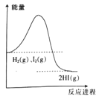
A. 该反应是吸热反应
B. 断裂0.05molH-H键和0.05molI-I键消耗的总能量小于生成0.1molH-I键释放的总能量
C. 当容器中气体密度不变时,说明反应已达到平衡状态
D. 达到平衡时,生成HI的分子数约为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 丙烷和丁烷互称为同系物
B. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C. 沸点:正丁烷>异丁烷>丙烷
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com