
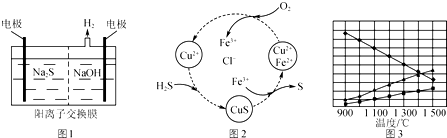
分析 (1)①阴极上氢离子放电生成氢气,阳极上硫离子放电,电极反应式为S2--2e-═S;
②Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S;
(2)①根据图中各元素化合价变化分析,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价;
②根据氧化还原反应中得失电子相等计算;
③使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质;
(3)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,再结合反应条件书写方程式.
解答 解:(1)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,
故答案为:Sn2-+2H+=(n-1)S↓+H2S↑;
(2)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,
故答案为:Cu、H、Cl;
②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,消耗O2的物质的量=$\frac{1mol}{2}$=0.5mol,
故答案为:0.5mol;
③使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:增大混合气体中空气的比例;
故答案为:增大混合气体中空气的比例;
(3)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,所以该反应方程式为2H2S $\frac{\underline{\;高温\;}}{\;}$2H2+S2,
故答案为:2H2S $\frac{\underline{\;高温\;}}{\;}$2H2+S2.
点评 本题以S及其化合物的性质为载体考查了电解原理的应用、氧化还原反应,图象分析判断等知识点,会正确分析图象中各个物理量的含义是解本题关键,再结合氧化还原反应中各个物理量之间的关系,化学方程式书写等有关知识来分析解答即可,题目难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 热稳定性:HF>HI>HBr>HCl | |
| D. | 熔点由高到低:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH(CH2)2CH3 | B. | CH2=CH(CH2)2CH3 | ||
| C. | CH3CH2 CH=CH2 | D. | CH3CH2CH=CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性 的维生素C,可防止该现象发生 | |
| C. | 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X 元素的氢氧化物碱性弱 | |
| D. | X元素的最高化合价比Y 元素的最高化合价高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com