
| A. | 第二周期的核电荷数和最高化合价之间的关系 | |
| B. | 烷烃中碳原子数(X)与氢原子数(Y)的关系 | |
| C. | 温度大于100℃时,CH4和C2H4的混合气体在氧气中充分燃烧,同温同压下燃烧前后参与反应的气体的体积之和(X)与生成物的气体体积之和(Y)的关系 | |
| D. | 燃烧一定质量C2H4与C3H6的混合气体,消耗O2的物质的量(Y)与C3H6的质量分数(X)的关系 |
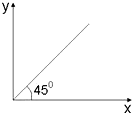
分析 从图象可知,符合图象关系应该满足的关系为X:Y=1,据此解答.
解答 解:A.第二周期氧和氟无最高正价,使核电荷数比除氧、氟之外的元素多2,故A错误;
B.烷烃的通式为CnH(2n+2),碳氢原子个数比等于X:Y=n:(2n+2)≠1,故B错误;
C.温度大于100℃时,水是气体,烃的燃烧通式为:CxHy+(x+$\frac{y}{4}$)O2 $\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O,反应前后气体体积比X:Y=(1+x+$\frac{y}{4}$):(x+$\frac{y}{2}$),CH4和C2H4的氢原子均为4,解y=4,带入X:Y=(2+x):(2+x)=1,故C正确;
D.消耗O2的物质的量(Y)的单位是摩尔而C3H6的质量分数(X)无单位,两者不等,故D错误;
故选C.
点评 本题考查了烷烃结构,燃烧规律,元素周期径律等概念,题目难度不大,属于基本知识的考查,解题的关键在于分析图中Y与X的关系.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
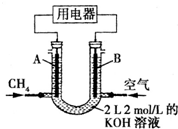 将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解可获得乙烯、丙烯和丁二烯 | |
| B. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| D. | 酚醛树脂、聚酯纤维(涤纶)都是由缩聚反应制得的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2SO4难溶于水 | B. | Li遇浓硫酸产生“钝化”现象 | ||
| C. | LiOH的水溶液不能使酚酞变红 | D. | Li2CO3受热分解,生成Li2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化镁的分子式为MgCl2 | B. | 氮原子的轨道表达式为: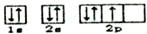 | ||
| C. | 硫原子的外围电子排布式为3s23p4 | D. | N2的结构式: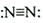 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有 x+1 | B. | 可能是 x+8或 x+18 | ||
| C. | 可能是 x+2 | D. | 可能是 x+1或 x+11或x+25 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 升高温度该反应的平衡常数K减小 | |
| B. | 该反应的△S<0 | |
| C. | 反应达平衡时吸热15.9kJ | |
| D. | 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com