
分析 (1)①K为生成物浓度幂之积与反应物浓度幂之积的比,纯固体不能代入K的表达式中;
②n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,由反应可知,消耗CO为0.2mol×$\frac{3}{2}$=0.3mol,结合v=$\frac{△c}{△t}$计算;
(2)结合平衡的特征“等、定”及衍生的物理量判断.
解答 解:(1)①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的平衡常数表达式K=$\frac{{{{[C{O_2}]}^3}}}{{{{[CO]}^3}}}$,故答案为:=$\frac{{{{[C{O_2}]}^3}}}{{{{[CO]}^3}}}$;
②n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,由反应可知,消耗CO为0.2mol×$\frac{3}{2}$=0.3mol,则10min内CO的平均反应速率为$\frac{\frac{0.3mol}{2L}}{10min}$=0.015mol/(L•min),
故答案为:0.015mol/(L•min);
(2)A、生成CO的速率等于生成CO2的速率,可知正逆反应速率相等,为平衡状态,故A选;
B、生成CO的速率等于消耗CO2的速率,均为逆反应速率,不能判定平衡,故B不选;
C、该反应前后气体的物质的量不变,容器内压强始终不再变化,不能判定平衡,故C不选;
D、CO的质量不再变化,由平衡特征“定”可知,为平衡状态,故D选;
E、气体的质量为变量,则容器内密度不再变化,为平衡状态,故E选;
故答案为:ADE.
点评 本题考查化学平衡计算,为高频考点,把握K的表达式、速率计算及平衡判定为解答的关键,侧重分析与应用能力的考查,注意固体不能代入K中,题目难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 可用KI鉴别淀粉溶液和Na2CO3溶液 | |
| B. | 隔夜蔬菜中的部分硝酸盐被氧化为有毒的亚硝酸盐 | |
| C. | 沾附水滴的铁质餐具生锈是化学腐蚀所致 | |
| D. | 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液呈酸性,可用氯化铁溶液蚀刻铜电路板 | |
| B. | 铝的金属性比钒强,可用铝与五氧化二钒反应制取金属钒 | |
| C. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| D. | 二氧化硫具有漂白性,能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
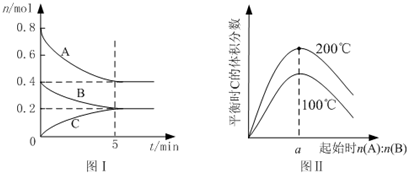
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)+Q(Q>0) | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 由图I可知,该反应式为2A(g)+B(g)?C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴加氢氧化钠溶液 | B. | 硫酸铁溶液中滴加硫氰化钾溶液 | ||
| C. | 氯化亚铁溶液中滴加氯水 | D. | 氯化铁溶液中加入还原铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
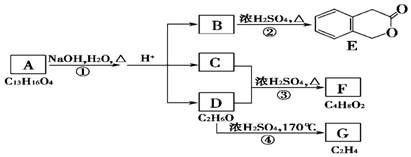
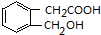
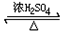
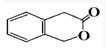 +H2O(有机物须用结构简式表示)
+H2O(有机物须用结构简式表示)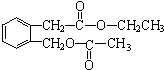 ;反应④的反应类型是消去反应.
;反应④的反应类型是消去反应. .
.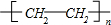 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com