
 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12.如图是向10mLAgNO3溶液中逐滴加入0.1mol•L-1NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12.如图是向10mLAgNO3溶液中逐滴加入0.1mol•L-1NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中x点的坐标为(10,6) | |
| C. | 图中x点表示溶液中c(Ag+)=c(Cl-) | |
| D. | 把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
分析 A.根据pAg=-lg{c(Ag+)}求出Ag+的浓度;
B.x点c(Ag+)=10-6 mol•L-1,根据硝酸银的量求出消耗的氯化钠;
C.x点c(Ag+)=10-6 mol•L-1,结合Ksp计算;
D.由于Ksp(AgI)更小,所以c(Ag+)更小.
解答 解:A.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol•L-1,即原AgNO3溶液的物质的量浓度为1 mol•L-1,故A错误;
B.x点c(Ag+)=10-6 mol•L-1,一般认为溶液中离子浓度小于10-5 mol•L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol•L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故B错误;
C.x点c(Ag+)=10-6 mol•L-1,c(Cl-)=$\frac{1×1{0}^{-12}}{1×1{0}^{-6}}$=1×10-6 mol•L-1,则Ag+与Cl-的浓度相同,故C正确;
D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol•L-1的NaCl换成0.1mol•L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误;
故选C.
点评 本题考查了难溶物溶解平衡及其影响,题目难度中等,注意把握题干中的信息,考查学生分析题目信息并用于解决问题的能力.


科目:高中化学 来源: 题型:解答题

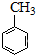 $→_{水溶加热}^{浓H_{2}SO_{4}浓HNO_{3}}$
$→_{水溶加热}^{浓H_{2}SO_{4}浓HNO_{3}}$
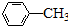 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$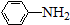 (弱碱性,易被氧化)
(弱碱性,易被氧化) .
.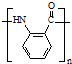 .
. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构. →B
→B 等.
等. 的同分异构体:
的同分异构体: 、
、 等
等 属于不同类别
属于不同类别 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷燃烧 | |
| B. | 乙烯通入酸性高锰酸钾溶液中 | |
| C. | 在镍做催化剂的条件下,苯与氢气反应 | |
| D. | 乙烷与氯气在光照下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气中含有的少量氯化氢,可用氢氧化钠溶液除去 | |
| B. | NaHCO3的热稳定性比Na2CO3强 | |
| C. | 过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+ | |
| D. | 氨气喷泉实验说明氨气极易溶解于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
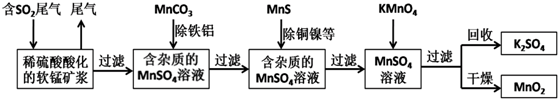
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 需加入的试剂 | 有关离子方程式 |
| FeSO4 (Fe2(SO4)3) | ||
| Mg(Al) | ||
| CO2 (HCl) | ||
| SiO2(CaCO3) | . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钠溶液中滴入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| C. | 在KHSO4溶液中加入少量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| D. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com