
| A、CH3COOCH2CH3+HOD→CH3COOD+CH3CH2OH |
| B、CH3COOCH2CH3+HOD→CH3COOH+CH3CH2OD |
| C、CH3CO18OCH2CH3+H2O→CH3CO18OH+CH3CH2OH |
| D、CH3C18OOC H2CH3+H2O→CH3C18OOH+CH3CH2OH |


科目:高中化学 来源: 题型:
| A、用完的电池可以随意地丢弃 |
| B、增加炼铁高炉的高度可以降低尾气中CO的含量 |
| C、加入正催化剂是能大大提高化学反应速率 |
| D、把煤粉碎了再燃烧不可以提高煤的燃烧效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16 g甲烷分子中含有共价键的数目为2NA |
| B、常温常压下,30g葡萄糖含有的氧原子数为NA |
| C、0.1mol/L的AlCl3溶液中含有的氯离子数为0.3NA |
| D、25℃时,1L 0.1mol/L的CH3COOH溶液中的H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2 mol?L-1 NaHCO3溶液中加入等体积0.1 mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol?L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CCl4中含有氯原子数目为4NA |
| B、0.05mol硫酸氢钠晶体中含离子总数为0.15NA |
| C、常温下,16g O2与O3的混合气体中含氧原子数为NA |
| D、一定条件下,2mol二氧化硫和1mol氧气混合,反应时转移的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、图 表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点 |
B、图 表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 |
C、图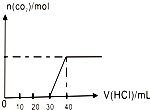 表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况 |
D、图 表示向100mL 0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 |
滤液A中有Fe3+ | |
| 步骤2:在滤液A中加入 |
滤液A中有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com