
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
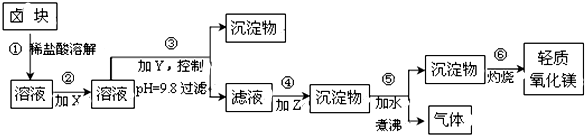
分析 为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,
(1)依据图表数据和经济效益分析加入的试剂的最佳选择;
(2)次氯酸钠具有氧化性在酸溶液中氧化亚铁离子为铁离子,据此写出反应的离子方程式;Z为碳酸钠,则步骤④生成沉淀为碳酸镁,碳酸镁在加热条件下水解生成氢氧化镁和二氧化碳气体;
(3)步骤③的目的在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去;
(4)步骤⑥为灼烧氢氧化镁制取氧化镁,应在坩埚中进行;
(5)氢氧化镁电离出来的OH-与NH4+结合生成弱电解质NH3•H2O,从而促进Mg(OH)2的溶解,据此分析解答.
解答 解:(1)步骤②是为了将Fe2+氧化成Fe3+,并在控制合适的pH条件时生成Fe(OH)3沉淀而除之,虽然漂液和H2O2都可采用,但对比表2提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理,故X为漂液;加入Y的目的是调节pH,选用氢氧化钠,故Y为烧碱;加入Z的目的是使镁离子沉淀,Z为纯碱;
故答案为:acd;
(2)流程中加入次氯酸钠在酸性溶液中会氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
加入的Z物质为纯碱,所以步骤④生成的沉淀物是MgCO3,所以沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2和CO2气体,反应的化学方程式为:MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑,
故答案为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑;
(3)步骤③的目的在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,应加入NaOH,如加入纯碱,不能达到较高的PH,分析表1提供的数据:除去杂质离子合理的pH范围是3.7<pH<9.8,在此范围内,如果pH过高,就会有大量的Mg2+生成Mg(OH)2而进入沉淀中,从而导致生产成本的提高;为了兼顾产品质量和生产成本,选择pH=9.8最合理,当然此时Mg2+也会部分生成Mg(OH)2沉淀,但由于卤块价格低廉,这点不可避免的损失还是可以承受的,以此保证产品的纯度,
故答案为:使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;
(4)步骤⑥由氢氧化镁灼烧制备氧化镁,应该在耐高温的坩埚中进行,
故答案为:坩埚;
(5)氢氧化镁溶液中存在溶解平衡Mg(OH)2?Mg 2++2OH-,Mg(OH)2电离出来的OH-与NH4+结合生成难电离的弱电解质NH3•H2O,氢氧根离子浓度降低,从而使Mg(OH)2的溶解平衡向右移动,促进氢氧化镁溶解,故Mg(OH)2能溶于NH4Cl溶液中,
故答案为:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
点评 本题通过以卤块为原料制取轻质氧化镁的工艺流程,考查了物质制备实验方案的设计,题目难度中等,注意掌握化学基本实验操作方法,明确物质制备实验方案设计原则,本题中合理分析制取流程、得出氧化镁的制备原理为解题的关键,试题综合性较强、涉及知识点较多,充分考查了学生的分析、理解能力及化学实验能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
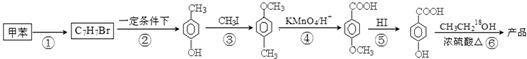
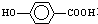 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.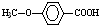 的同分异构体很多,其中符合下列条件有3种.
的同分异构体很多,其中符合下列条件有3种. .
.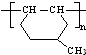 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烷(乙炔):将混合气体通过酸性高锰酸钾溶液,洗气除去乙烷中的乙炔气体 | |
| B. | 苯(苯酚):向混合液中加入适量的浓溴水,过滤,除去苯中的少量苯酚 | |
| C. | 酒精(水):向含水酒精中加入生石灰,蒸馏,得到无水酒精 | |
| D. | 硝基苯(NO2):向溶有杂质的硝基苯加入一定量的浓氢氧化钠溶液,振荡,分液可除去中溶解的NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.001 mol•L-1 | B. | O.002 mol•L-1 | C. | 0.003 mol•L-1 | D. | O.00125 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 将1 L 0.1 mol•L-1的Ba(OH)2溶液稀释为2 L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2Mg5Si8O22(OH)2属于硅酸盐 | |
| B. | 昆仑玉是混合物,透闪石中Mg元素与Ca元素的质量比是3:2 | |
| C. | 透闪石的化学式写成氧化物的形式为:2CaO•5MgO•8SiO2•H2O | |
| D. | 透闪石是一种新型无机非金属材料,易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2分子内含有极性键,但C2H2分子是非极性分子 | |
| B. | 分子晶体、原子晶体一定含有共价键,离子晶体一定含有离子键 | |
| C. | 气态氢化物的稳定性随着其相对分子量的增大而增强 | |
| D. | 某非金属元素从游离态变成化合态时,该元素一定被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com