
| 事实 | 推测 | |
| A | 12Mg与水反应缓慢,20Ca与水反应较快 | 56Ba(IIA族)与水反应更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | Ⅳ族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.同一主族元素,元素的金属性随着原子序数增大而增强,元素的金属性越强,其与水反应越剧烈;
B.处于金属和非金属分界线处的元素具有金属性和非金属性;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.元素的非金属性越强,其与氢气化合越容易.
解答 解:A.同主族金属元素由上至下金属性增强,与水反应剧烈程度增强,金属性Ba>Ca>Mg,Ca与水反应较快则Ba与水反应更快,故A正确;
B.半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,Si和Ge处于金属和非金属分界线处,能作半导体,但C和Pb不能作半导体,所以第IVA族元素并不都是半导体材料,故B错误;
C.同主族非金属元素由上至下非金属性减弱,气态氢化物的热稳定性减弱,非金属性Cl>Br>I,所以HBr的分解温度介于二者之间,故C正确;
D.同周期非金属元素从左到右非金属性增强,与氢气化合难度减小,非金属性S>P>Si,所以 P与H2在高温时能反应,故D正确;
故选B.
点评 本题考查元素周期律的应用,涉及同一主族、同一周期元素性质递变规律,明确原子结构与元素性质的关系是解本题关键,熟练掌握碱金属族、卤族及第三周期元素性质递变规律,题目难度不大.


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
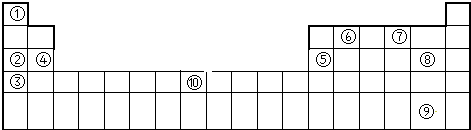
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Z |
| A. | 离子半径:r(Y)>r(Z)>r(W) | |
| B. | Z的简单离子能破坏水的电离平衡 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z的简单气态氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丙>丁>乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 聚酯(PET) |  聚氯乙烯(PVC) |  聚丙烯((PP) |  聚苯乙烯(PS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | NH3 | CO2 |
| B | Cl2 | CO2 |
| C | SO2 | NO2 |
| D | Cl2 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 有机硅聚醚(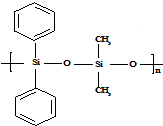 )可由单体 )可由单体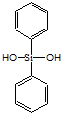 和 和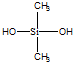 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
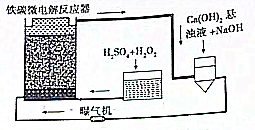 铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.
铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com