
(3分)(1)我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)海水中镁的总储量约为2×1015 t,目前世界上生产的镁有60%来自海水,海水中的镁元素处于 (填“游离态”或“化合态”),从海水中提取氯化镁 (填 “属于”或“不属于”)氧化还原反应。
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省福清东张中学高一上学期期末考试化学试卷(带解析) 题型:填空题
(3分)(1)我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)海水中镁的总储量约为2×1015 t,目前世界上生产的镁有60%来自海水,海水中的镁元素处于 (填“游离态”或“化合态”),从海水中提取氯化镁 (填 “属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源:2011-2012年学福建省高二上学期期中考试化学试卷 题型:填空题
(24分,每空3分)
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为_____________________________________
②平衡时SO2的转化率______________________________________
③平衡时SO3的体积分数为___________________________
④10s时O2的浓度为_____________________________________________
(2)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。
qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n______q;(填“>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)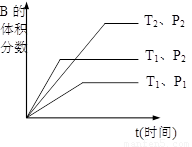
(3)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 ______________移动。
②在溶液中加入少量的KCl固体,平衡 _____________移动。
查看答案和解析>>
科目:高中化学 来源:2013届吉林省长春市高二上学期期末考试化学试卷 题型:填空题
(3分)(227℃,1个大气压时),1.5L某烃蒸汽能在aL氧气中完全燃烧,体积增大到(a+3)L(相同条件下),问:
(1)该烃在组成上必须满足的基本条件是
(2)当a=10L时,该烃可能的分子式
(3)当该烃的分子式为C7H8时,a的取值范围为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com