
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是
|
B.五种元素中原子半径最大的是X
C.气态氢化物稳定性:Y>T
D.Z元素的最高价氧化物对应的水化物的化学式为HZO4
科目:高中化学 来源: 题型:
下列三种有机物是某些药物中的有效成分。


下列说法正确的是( )
A.三种有机物都能发生水解反应 B.使用FeCl3溶液和稀硫酸可以鉴别这三种有机物
C.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
D.将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.80mL 10mol 浓盐酸与足量MnO2反应,转移电子数为0.4NA
浓盐酸与足量MnO2反应,转移电子数为0.4NA
B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
C.1 mol A13+含有核外电子数为3NA
D.常温下,16g CH4中共用电子对的数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙的流程如下:

回答下列问题:
32、电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
33、氯化过程的温度控制在75~80℃,该过程主要反应的离子方程式为: _______________________________________________________________
34、该流程中加入活性炭的作用是
35、碳化过程中,先向溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。

如果按气流方向连接各仪器接口,你认为正确的顺序为a→ 、 → 、 →i。其中与i相连漏斗的作用是 。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是 (填编号)

36、副产品A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.3mol NO2与水充分反应,转移nA个电子
B.常温常压下,18g H2O含有3nA个原子
C.1L 0.1 mol·L-1NaHCO3溶液中含有0.1nA个HCO3-
D.标准状况下,2.24L乙醇含有0.1nA个CH3CH2OH分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,溶液中始终无明显现象的是
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
甲酸甲酯水解反应方程式为:
 ≒
≒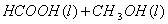

某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:

甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:

请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为: ,则该反应在温度
,则该反应在温度
T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1HClO溶液所得滴定曲线如下图。下列说法正确的是

A.点①所示溶液中:c(ClO-)+c(OH-)=c(HClO)+c(H+)
B.点②所示溶液中:c(Na+)=c(HClO)+c(ClO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(ClO-)>c(H+)
D.滴定过程中可能出现:c(HClO)>c(ClO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com