
| T/℃ | 30 | 40 | 50 |
| 生成 NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
分析 I.(1)由速率单位可知,用单位时间内物质的量变化量表示反应速率,根据v=$\frac{△n}{△t}$计算v(NH3),再利用速率之比等于化学计量数之比计算v(O2);
(2)升高温度、增大压强或浓度、使用催化剂等可以加快反应速率,要增加NH3产率,应改变条件使平衡正向移动;
(3)根据反应放出的热量计算各组分物质的量变化量,再计算平衡时各组分物质的量浓度,根据K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
Ⅱ.(1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
(2)设平衡时CO的转化率为a,表示出平衡时各组分物质的量,反应前后气体的物质的量不变,用物质的量代替浓度代入平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$=4计算;
欲提高(2)中CO的平衡转化率,应改变条件使平衡正向移动,注意增大CO的浓度,等效为增大压强,平衡不移动,CO转化率不变;
(3)$\frac{c(CO)}{c({CO}_{2})}$值为$\frac{2}{3}$Fe(s)+CO2(g)?$\frac{1}{3}$Fe2O3(s)+CO(g)的平衡常数,只受温度影响.
解答 解:I.(1)由速率单位可知,用单位时间内物质的量变化量表示反应速率,50℃时从开始到3h内v(NH3)=$\frac{6.0×1{0}^{-6}mol}{3h}$=2×10-6mol/h,速率之比等于化学计量数之比,则v(O2)=$\frac{3}{4}$v(NH3)=1.5×10-6mol/h,
故答案为:1.5×10-6;
(2)A.升高温度反应速率加快,正反应为吸热反应,升高温度平衡正向移动,NH3产率增大,故A正确;
B.将NH3从体系中分离,平衡正向移动,NH3产率增大,但反应速率减慢,故B错误;
C.恒容条件下,充入He,反应混合物各组分浓度不变,反应速率不变、平衡不移动,NH3产率不变,故C错误;
D.加入合适的催化剂,反应速率增大,平衡不移动,NH3产率不变,故D错误,
故选:A;
(3)在某10L恒容的密闭容器中加入2molN2和4molH2,达到平衡时放出的热量为92.4KJ,参加反应的氮气为1mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 4 0
变化量(mol):1 3 2
平衡量(mol):1 1 2
则平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{(\frac{2}{10})^{2}}{\frac{1}{10}×(\frac{1}{10})^{3}}$=400,
A.混合气体总质量不变,随反应进行混合气体物质的量减小,容器中气体的平均相对分子质量增大,当平均相对分子质量不随时间而变化时,说明到达平衡,故A正确;
B.应是3v正(NH3)═2v逆(H2)时,反应到达平衡,故B错误;
C.没有指明正逆反应速率,N2、H2、NH3三种物质的正反应速率之比始终为1:3:2,故C错误;
D.随反应进行混合气体物质的量减小,恒温恒容下压强减小,容器中总压强不随时间而变化,说明反应到达平衡,故D正确;
E.反应的△H与化学计量数等有关,与是否到达平衡无关,故E错误,
故选:AD;
Ⅱ.(1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,则该反应的△H<0,故答案为:<;
(2)设平衡时CO的转化率为a,转化的CO为a mol,则:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
起始量(mol):1 1
变化量(mol):a a
平衡量(mol):1-a 1+a
反应前后气体的物质的量不变,用物质的量代替浓度计算平衡常数,则K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{1+a}{1-a}$=4,解得a=60%;
欲提高(2)中CO的平衡转化率,应改变条件使平衡正向移动,注意增大CO的浓度,等效为增大压强,平衡不移动,CO转化率不变,
A.减少Fe的量,平衡不移动,CO转化率不变,故A错误;
B.增加Fe2O3的量,平衡不移动,CO转化率不变,故B错误;
C.移出部分CO2,平衡正向,CO转化率增大,故C正确;
D.正反应为放热反应,提高反应温度,平衡逆向移动,CO转化率减小,故D错误;
E.减小容器的体积,压强增大,平衡不移动,CO转化率不变,故E错误;
F.加入合适的催化剂,缩短到达平衡的时间,不影响平衡移动,CO转化率不变,故F错误,
故答案为:60%;C;
(3)$\frac{c(CO)}{c({CO}_{2})}$值为$\frac{2}{3}$Fe(s)+CO2(g)?$\frac{1}{3}$Fe2O3(s)+CO(g)的平衡常数,只受温度影响,该反应为吸热反应,升高温度平衡正向移动,平衡常数增大,
故选:D.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、平衡常数、反应速率等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaCl溶液表示的是1L溶剂中溶解0.1mol NaCl的溶液 | |
| B. | 将0.1mol氧化钠溶于水并配成1L溶液,则溶液的物质的量浓度为0.1mol•L-1 | |
| C. | 物质的量浓度和溶质质量分数均是表示溶液组成的物理量 | |
| D. | 0.1mol•L-1的CaCl2溶液中c(Cl-)也为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
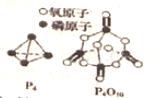 已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,则表中x(用含有a、b、c、d的代数式表示)为( )
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,则表中x(用含有a、b、c、d的代数式表示)为( ) | 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | a | b | c | x |
| A. | 12b-d-6a-5c | B. | -(d+6a+5c-12b) | C. | d+6a+5c-12b | D. | d+6a.5c-12b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-Q1 2H2(g)+O2(g)═2H2O(l)△H=-Q2 | |
| B. | S(g)+O2(g)═SO2(g)△H=-Q1 S(s)+O2(g)═SO2(g)△H=-Q2 | |
| C. | C(s)+O2(g)═CO2(g)△H=-Q1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-Q2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H=-Q1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
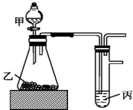 用如图装置进行实验,根据实验现象所得结论正确的是( )
用如图装置进行实验,根据实验现象所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 漂白粉溶液 | 酸性:HCl>H2CO3>HClO |
| B | 盐酸 | 硫化亚铁 | 硫酸铜溶液 | 酸性:HCl>H2S>H2SO4 |
| C | 水 | 过氧化钠 | 水 | 过氧化钠与水的反应是放热反应 |
| D | 浓盐酸 | 二氧化锰 | 碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、纤维素、蔗糖、油脂都是高分子化合物 | |
| B. | 可用浓硝酸鉴别含苯环的蛋白质 | |
| C. | 工业上利用油脂在碱的催化作用下水解生产肥皂 | |
| D. | 淀粉水解与纤维素水解得到的最终产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水稀释,盐溶液中各离子的物质的量浓度均将减小 | |
| B. | 常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,则△H<0 | |
| C. | 足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少说明是强酸 | |
| D. | 反应CaSO4(s)+CO32-(aq)?CaCO3 (s)+SO42-(aq) 的实质就是沉淀溶解平衡的移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com