
为了使鸡蛋保鲜时间更长,有人提出了四种方法:①放入冰箱中;②放入食盐水中;③放入石灰水中;④煮熟了保存.你认为最好的方法是____________(填序号)。
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
点燃两支短蜡烛,分别放在白铁皮架的两个阶梯上,把铁皮架放在烧杯里,沿烧杯壁倾倒二氧化碳.在实验过程中观察到的现象是__________________________;说明二氧化碳具有_______________________的性质。
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列实验现象描述不正确的是( )
A.木炭在氧气中燃烧,发出白光 B.硫在氧气中燃烧发出明亮的蓝紫色火焰
C.一氧化碳在空气中燃烧发出蓝色火焰 D.白磷在空气中燃烧发出淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钙与氧化钙组成的混合物共100g,测得其中钙元素的质量分数为46.25%.在高温条件下煅烧此混合物,生成的气体完全被足量的澄清石灰水吸收,称得石灰水的质量增重35.2g,试计算:
(1)钙元素的相对原子质量。(精确到0.01)
(2)原混合物中碳酸钙的质量分数。(精确到0.01%)
查看答案和解析>>
科目:高中化学 来源: 题型:
对下面符号或示意图的理解,正确的是( )
A.Fe2+、Fe3+都属于铁元素,是同一种离子
B.NO2、N2O4中氮元素的化合价都是+4价,是同一化合物
C.NH4NO3中氮元素有两种不同的化合价,分别是-3、+5
D.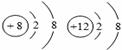 两种粒子的电子排布情况相同,属于同一元素
两种粒子的电子排布情况相同,属于同一元素
查看答案和解析>>
科目:高中化学 来源: 题型:
研究化肥的合成、废水的处理等有现实的重要意义。
Ⅰ.尿素是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
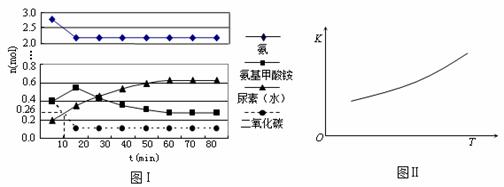
① 已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定。
② 反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则用CO2表示的第一步反应的速率v(CO2)=____________________
③ 第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 0
(填“>”“<”或“=”)
Ⅱ.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
(3)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,
c(AsO43-)最大是 mol·L-1。
(4)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
(5)在处理含砷废水时采用分段式,先向废水中投入适量生石灰调节pH到2,再投入适量生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
① 将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②在pH调节到8左右才开始出现大量Ca3(AsO4)2沉淀的原因为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com