
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
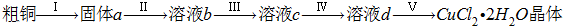
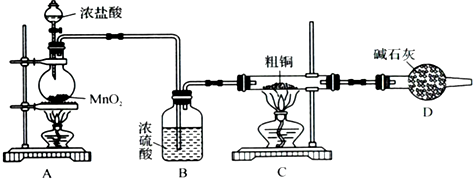
查看答案和解析>>
科目:高中化学 来源: 题型:
【查阅资料】
①铁的常见氧化物
名称 | 化学式 | 色、态 | 铁元素的质量分数 |
氧化亚铁 | FeO | 黑色粉末 | w(Fe)=77.8% |
氧化铁 | Fe2O3 | 红棕色粉末(俗称铁红) | w(Fe)=70.0% |
四氧化三铁 | Fe3O4 | 黑色晶体(俗称磁性氧化铁) | w(Fe)=72.4% |
②草酸(乙二酸H2C2O4)在浓硫酸存在下受热分解的化学方程式为H2C2O4![]() CO2↑+ CO↑+H2O
CO2↑+ CO↑+H2O
【实验准备】
①实验的装置图如下

②药品
a.草酸 b.工业铁红 c.NaOH溶液 d.澄清石灰水 e.浓硫酸 f.盐酸
【实验及数据】
取不同质量的样品进行实验,所得实验数据如下:
实验序号 | 样品质量/g | 生成铁的质量/g |
1 | 4.00 | 2.91 |
2 | 8.00 | 7.00 |
3 | 10.00 | 7.27 |
4 | 12.00 | 8.72 |
5 | 14.00 | 10.18 |
6 | 16.00 | 11.63 |
【讨论与分析】
(1)兴趣小组的同学拟以纯净的CO还原铁的氧化物,所设计的实验装置中D、E、F应分别盛放的试剂为____________、____________、___________(填写序号),其作用依次是____________、____________、_____________。上述装置还有不完善之处,你建议改进的措施是________________________。
(2)由实验数据不难得出,有一组实验数据不可靠,该组数据是____________(填序号),该工业铁红所含杂质的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省“江南十校”高三3月联考理综化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组
设计SnSO4制备路线如下:
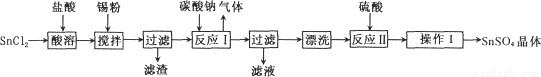
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作l的步骤为 ____、____、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_____________。
(2) SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:________。
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是:________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnC12中加入过量的FeC13溶液,用b mol/LK2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液m ml。则锡粉中锡的质量分数是________。(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

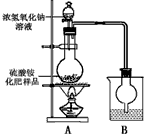
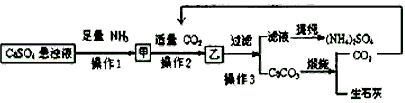
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com