

���� G��һ�������������GΪAl2O3����NaOH��Ӧ����JΪNaAlO2���������������Al��������I����NaOH��Һ��������NaAlO2����IΪAl����HΪO2��FΪ���ɫ��������FΪFe��OH��3��E��¶�ڿ�������������������ӦΪFe��OH��2��Fe��OH��3��ת��������EΪFe��OH��2��B�����ᷴӦ�õ�C��D��C��D�ֱ�ͼӦ����E��F��CΪdz��ɫ��Һ����CΪFeCl2��DΪFeCl3��BΪFe3O4��Fe3O4��Al�ڸ��������·������ȷ�Ӧ����AΪFe���ݴ˽��
��� �⣺G��һ�������������GΪAl2O3����NaOH��Ӧ����JΪNaAlO2���������������Al��������I����NaOH��Һ��������NaAlO2����IΪAl����HΪO2��FΪ���ɫ��������FΪFe��OH��3��E��¶�ڿ�������������������ӦΪFe��OH��2��Fe��OH��3��ת��������EΪFe��OH��2��B�����ᷴӦ�õ�C��D��C��D�ֱ�ͼӦ����E��F��CΪdz��ɫ��Һ����CΪFeCl2��DΪFeCl3��BΪFe3O4��Fe3O4��Al�ڸ��������·������ȷ�Ӧ����AΪFe��
��1��A��B��C��D��E��F����������������ͬһ��Ԫ���������ʴ�Ϊ��Fe��
��2�������Ϸ�����֪CΪFeCl2���ʴ�Ϊ��FeCl2��
��3����Ӧ���Ǹ���������������������Ӧ������������������Ӧ����ʽΪ��8Al+3Fe3O4$\frac{\underline{\;����\;}}{\;}$4Al2O3+9Fe��
��Ӧ���������������Ʒ�Ӧ����ƫ�����ƺ���������Ӧ���ӷ���ʽΪ��2Al+2H2O+2OH-=2AlO2-+3H2����
�ʴ�Ϊ��8Al+3Fe3O4$\frac{\underline{\;����\;}}{\;}$4Al2O3+9Fe��2Al+2H2O+2OH-=2AlO2-+3H2����
���� ���⿼��������ƶϣ��漰Fe��AlԪ�ص��ʼ��仯��������ʣ���FΪ���ɫ������G��һ��������������ƶ�ͻ�ƿڣ��ٽ��ת����ϵ�ƶϣ���Ҫѧ����������Ԫ�ػ���������ʣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̼������Һ�мӹ������� CO32-+2H+=H2O+CO2�� | |
| B�� | ��ϡ������Һ��Ͷ������ 2Fe+6H+=2Fe3++3H2�� | |
| C�� | ��������Ͷ��̼��� CO32-+2H+=H2O+CO2�� | |
| D�� | .����������Һ�м������� H++OH-=H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
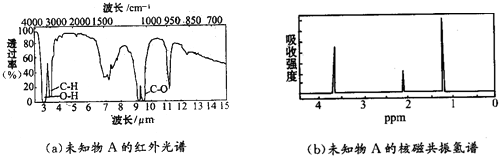
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��A | ��A | |||||||
| 1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
| 2 | �� | �� | �� | �� | ||||
| 3 | �� | �� | �� | �� | ||||
 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ڱ������ң�Ԫ�صĵ縺����� | |
| B�� | ���ڱ����ϵ��£�Ԫ�صĵ縺����� | |
| C�� | �縺��Խ������Խǿ | |
| D�� | �縺��ԽС���ǽ�����Խǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H1��0����H3��0 | B�� | ��H2��0����H4��0 | C�� | ��H2=��H1+��H3 | D�� | ��H3=$\frac{V{H}_{4}+2V{H}_{5}}{3}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�� | �ṹ�����ʵ���Ϣ |
| X | �����л���ĺ���Ԫ�أ���Ԫ�ص�һ�����������̬�⻯�ﶼ�ǵ��͵��������� |
| Y | �������У���ϡ�������⣩ԭ�Ӱ뾶����Ԫ�أ��õ���Һ̬ʱ�������˷�Ӧ�ѵĴ��Ƚ��� |
| Z | ��Yͬ���ڣ�������������ˮ��������� |
| M | ��ˮ�г��⡢��Ԫ���⺬������Ԫ�أ��䵥�ʻ���Ҳ������ˮ���������г��õ�����ɱ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com