
【题目】在无色透明的酸性溶液中,能大量共存的一组离子是
A. K+、AlO2-、Na+、Cl- B. Na+、Al3+、NO3-、SO42-
C. Fe2+、Na+、Cl-、OH- D. K+、Na+、NO3-、CO32-
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述正确的是
A. 14C可用于文物年代的鉴定
B. BaCO3在医学上可用作钡餐
C. 明矾可用于饮用水消毒
D. 高纯度的SiO2可用于制光电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下:

(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_________。写出A+B→C的化学反应方程式__________________________。
(2)C 中①、②、③3个—OH的酸性由强到弱的顺序是:_______。
中①、②、③3个—OH的酸性由强到弱的顺序是:_______。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有_____种。
(4)D→F的反应类型是______,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为_______mol。写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式____。
①属于一元酸类化合物 ②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:![]() 。A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
。A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途。
(1)Be基态原子的轨道表示式为_________________________;
镁和铝的笫二电离能:I2(Mg)_____I2(Al) (填“>”“ <”或“=”)。
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4, ( )的形式存在,在1000 ℃,氯化铍则以BeCl2形式存在。
)的形式存在,在1000 ℃,氯化铍则以BeCl2形式存在。
①在二聚体Be2Cl4中Be的杂化方式为___________,1mol Be2Cl4中含有_________mol 配位键。
②MgCl2的熔、沸点比BeCl2高的原因是____________________。
(3)根据巴索洛规则:一般来讲,盐中阴、阳离子半径相差较大时,其溶解度较大。则在水中溶解度 S(SrF2)____S(BaF2) (填“>” “<””或“=”)。
(4)石灰氮(CaCN2)—种碱性肥料,可用作除草剂、杀菌剂、杀虫剂等。
①CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),写出CN22-的电子式___________。
②CaCN2与水反应生成CaCO3和NH3两种物质,则1mol CaCN2与水反应的过程中,反应物断裂的σ键总数_______________。
(5) Mg2+与Ni2+、 O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为_________。已知该品胞参数a pm.则该晶体的密度为_________g·cm-3(用a和NA表示)。
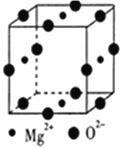
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用氧化剂+浓盐酸―→金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入50 mL 12.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
(1)反应过程中,被氧化的HCl的物质的量为________ mol。
(2)反应后溶液中HCl的物质的量浓度为______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应2XY(g)![]() X2(g)+Y2(g) 达到平衡的标志是
X2(g)+Y2(g) 达到平衡的标志是
A. 单位时间内,生成nmolX2的同时,生成nmolXY
B. 单位时间内, 生成nmolX2的同时,生成nmolY2
C. 单位时间内,生成2nmolXY的同时,消耗nmolY2
D. 单位时间内,生成nmolX2的同时,消耗nmolY2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
A. 用量筒量取25.00mLNa2CO3溶液
B. 用排水法收集NH4Cl与Ca(OH)2共热制得的氨气
C. 用澄清石灰水检验木炭与浓硫酸共热产生的气体中的CO2
D. 向溶有NO2的黄色浓硝酸中通入足量O2,使其变为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q具有漂白性,s在常温下为密度比水大且难溶于水的液体。0.01 mol/L r溶液的pH为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小:W<X<Y
B. 元素的非金属性:Z>X>Y
C. Y的氢化物常温常压下为气态
D. X的最高价氧化物的水化物为弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com