
【题目】元素X的单质及X与元素Y形成的化合物存在如图所示的关系(其中m≠n,且均为正整数).下列说法正确的是( )
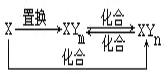
A. X一定是金属元素
B. (n-m)一定等于1
C. 由X生成1molXYm时转移的电子数目一定为4NA
D. 三个化合反应一定都是氧化还原反应
【答案】D
【解析】A项,由产物组成可知X有多种价态,当X是铁时,Y可以氯元素等,可以发生如下反应:Fe+2HCl=FeCl2+H2↑、2FeCl2+Cl2=2FeCl3、2Fe+3Cl2![]() 2FeCl3、2FeCl3+Fe=3FeCl2,满足此框图;当X是碳时,Y可以是氧元素,存在反应:C+H2O
2FeCl3、2FeCl3+Fe=3FeCl2,满足此框图;当X是碳时,Y可以是氧元素,存在反应:C+H2O![]() CO+H2、C+O2
CO+H2、C+O2![]() CO2、2CO+O2
CO2、2CO+O2![]() 2CO2、CO2+C
2CO2、CO2+C![]() 2CO,也满足此框图,故A错误;B项,若X为碳,XYm是CO2,XYn为CO时,符合转化关系,则(n-m)≠1,故B错误;C项,若X为Fe,与盐酸反应生成XYm为FeCl2,XYn是FeCl3时,符合转化关系,生成1mol FeCl2时转移电子为2mol,故C错误;D项,有单质参加的化合反应属于氧化还原反应,置换反应都属于氧化还原反应,XYm与XYn中X元素的化合价不同,二者之间的反应也属于氧化还原反应,故D正确。此题答案选D。
2CO,也满足此框图,故A错误;B项,若X为碳,XYm是CO2,XYn为CO时,符合转化关系,则(n-m)≠1,故B错误;C项,若X为Fe,与盐酸反应生成XYm为FeCl2,XYn是FeCl3时,符合转化关系,生成1mol FeCl2时转移电子为2mol,故C错误;D项,有单质参加的化合反应属于氧化还原反应,置换反应都属于氧化还原反应,XYm与XYn中X元素的化合价不同,二者之间的反应也属于氧化还原反应,故D正确。此题答案选D。


科目:高中化学 来源: 题型:
【题目】已知反应:H2S(g)+aO2(g)===X+cH2O(l) ΔH,若ΔH表示该反应的燃烧热,则X为( )
A.S(s)B.SO2(g)C.SO3(g)D.SO3(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向150mL一定浓度的HNO3中加入44.8铜片,一段时间后,铜片完全溶解,硝酸恰好完全反应,共收集到气体(NO、NO2)22.4L(已折算成标准状况),则该HNO3的物质的量浓度是( )
A. 10.0molL-1 B. 16.0molL-1 C. 12.4molL-1 D. 18.7molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2______(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是____________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_____________mol·L-1。写出该混合溶液中的下列算式的精确结果 (数据不能做近似计算,不用化简)。c(Na+)-c(A-)=____________mol·L-1 c(OH-)-c(HA)=____________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中大量存在以下五种离子:Cl﹣、SO42﹣、Fe3+、H+、M,其物质的量浓度之比为c(Cl﹣):c(SO42﹣):c(Fe3+):c(H+):c(M)=5:3:2:3:2,则M可能是( )
A.Ag+
B.Mg2+
C.NO ![]()
D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性的澄清透明溶液中,能大量共存的离子组是( )
A. Al3+、Ag+、NO3—、Cl- B. Mg2+、NH4+、HCO3—、Cl-
C. Na+、K+、CO32—、Cl- D. Cu2+、Na+、NO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示

回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为 。
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为 。
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是 。
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为 ,反应的离子方程式为 。
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为 。
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com