
 某化学课外小组用如图装置制取溴苯.
某化学课外小组用如图装置制取溴苯.分析 (1)苯与溴在溴化铁作用下发生取代反应;
(2)溴与铁反应生成溴化铁,消耗溴,颜色变浅;
(3)溴能与氢氧化钠反应而溴苯不能;
(4)溴化氢气体中混有溴蒸气;如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.
解答 解:(1)苯与溴在溴化铁作用下发生取代反应,反应方程式为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
故答案为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
(2)溴与铁反应生成溴化铁,反应现象为:反应液微沸有红棕色气体充满A容器,
故答案为:反应液微沸有红棕色气体充满A容器;
(3)溴单质能与氢氧化钠溶液反应而溴苯不能,反应方程式:Br2+2NaOH═NaBr+NaBrO+H2O;
故答案为:除去溶于溴苯中的溴,便于观察溴苯的颜色;Br2+2NaOH═NaBr+NaBrO+H2O;
(4)CCl4 能溶解溴不能溶解溴化氢,四氯化碳能除去溴化氢气体中的溴蒸气;如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.也就是说,如果要证明苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成,溴化氢与硝酸银反应生成溴化银淡黄色沉淀或在D中加入石蕊试液,若变红则发生取代反应,
故答案为:除去溴化氢气体中的溴蒸气;石蕊试液;溶液变红色.
点评 本题考查苯与溴的取得反应,侧重于学生的分析能力和实验能力的考查,把握实验的原理和方法是解答该题的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
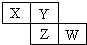 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | Y的氢化物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |

| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V${\;}_{N{H}_{3}}$=$\frac{4}{5}$V${\;}_{{O}_{2}}$ | B. | V${\;}_{N{H}_{3}}$=V${\;}_{{O}_{2}}$=V${\;}_{{H}_{2}O}$ | ||
| C. | V${\;}_{{O}_{2}}$=$\frac{4}{5}$VNO | D. | V${\;}_{{O}_{2}}$=$\frac{6}{5}$V${\;}_{{H}_{2}O}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com