
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 12 g C60中含有的碳原子数为60NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
分析 A、求出水的物质的量,然后根据1mol水中含10mol质子来分析;
B、C60由C原子构成;
C、NO2和N2O4的最简式均为NO2;
D、钠和氧气反应后变为+1价.
解答 解:A、18g水的物质的量为1mol,而1mol水中含10mol质子,即10NA个,故A正确;
B、C60由C原子构成,故12gC60中含有的C原子的物质的量为1mol,个数为NA个,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,则含3NA个原子,故C正确;
D、钠和氧气反应后变为+1价,故1mol钠反应后转移NA个电子,与产物的种类无关,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+是人体所需微量元素 | B. | 苯酚不能用于杀菌消毒 | ||
| C. | 氢气是未来的一种理想燃料 | D. | 乙醇是不可再生的生物质能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点由低到高的顺序为:CH3CH2CH3<CH3(CH2)2CH3<(CH3)3CH | |
| B. | 工业上合成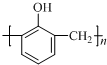 的单体为甲醛和苯酚( 的单体为甲醛和苯酚(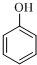 ) ) | |
| C. | 相同质量的乙烯和乙酸完全燃烧时,消耗氧气的量相同 | |
| D. | 某烷烃可以命名为2,3,3-三甲基-4-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+2H2O+4e-═4OH- | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,电解质溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
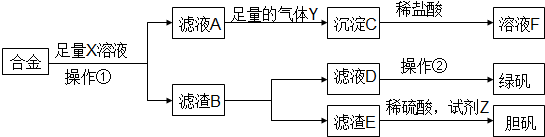
| A. | 溶液X为稀硫酸,气体Y为氨气 | |
| B. | 由溶液F获得溶质F固体的过程中,须控制条件防止其氧化和分解 | |
| C. | 使用足量稀硫酸时,试剂Z选用H2O2或适量HNO3均获得胆矾晶体 | |
| D. | 操作①为过滤,操作②为蒸发结晶、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Q | X | ||
| Y | Z | W | |
| T |
| A. | X、Z、Y元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | Q与氢元素形成的化合物中不存在非极性共价键 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,最高价氧化物对应水化物的化学式是H3TO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1000 |
| C(H2O)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| C(CO2)/mol•L-1 | 2.50 |
| A. | 在500s内用H2O(g)表示的化学反应速率是2.96×10-3mol•L-1•s-1 | |
| B. | 在500s时生成的CH4的浓度是0.74mol•L-1 | |
| C. | 在1000s时反应达到平衡 | |
| D. | 0-500s的平均反应速率大于500~1000s的平均反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
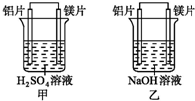 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com