
| A. | 20 g D2O 含有的质子数为10NA | |
| B. | 1mol Na2O2与足量水反应转移的电子数为NA,生成的气体在标况下的体积为22.4L | |
| C. | 1L 0.1mol/L HF溶液中含有共价键数目为0.1 NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
分析 A、求出重水的物质的量,然后根据重水中含10个质子来分析;
B、过氧化钠和水的反应中,1mol过氧化钠转移1mol电子,生成0.5mol氧气;
C、HF溶液中,除了HF有共价键,水中也含共价键;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、20g重水的物质的量为1mol,而重水中含10个质子,故1mol重水中含10NA个质子,故A正确;
B、过氧化钠和水的反应中,1mol过氧化钠转移1mol电子,生成0.5mol氧气,在标况下体积为11.2L,故B错误;
C、HF溶液中,除了HF有共价键,水中也含共价键,故溶液中的共价键个数无法计算,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故NA个氢氧化铁胶粒中氢氧化铁的物质的量大于1mol,则质量大于107g,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
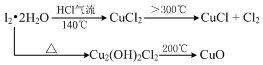
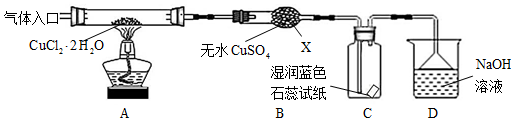
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其属于非极性(填“极
,其属于非极性(填“极
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的加聚反应产物 | |
| B. | 乙醇的消去反应产物 | |
| C. | 甲烷与氯气的取代反应中的有机产物 | |
| D. | 苯与氢气按1:3加成反应的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排水法收集铜粉与浓硝酸反应产生的NO2 | |
| B. | 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 | |
| C. | 用酸性KMnO4溶液验证草酸的还原性 | |
| D. | 用饱和NaHCO3溶液除去Cl2中混有的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多空的海绵状碳 | 浓硫酸具有脱水性和强氧化性 |
| B | 盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液. | 溶液变成棕黄色,一段时间后,溶液中有气泡出现,随后有红褐色沉淀生成. | Fe2+催化H2O2分解产生O2; H2O2分解反应放热,促进Fe3+的水解平衡正向移动. |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3 溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com