
| A. | 镁元素基态原子的核外电子排布式是:1s22s22p63s2 | |
| B. | 铝元素原子核外共有5种不同运动状态的电子 | |
| C. | 钠元素离子半径比铝离子半径大 | |
| D. | 金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+3H2↑ |
分析 A.镁元素原子序数为12,有三个电子层,最外层为2个电子;
B.原子核外有几个电子就有几种不同的运动状态;
C.钠离子和铝离子电子层数相同,原子序数越大离子半径越小;
D.金属铝与钠的最高价氧化物的水化物溶液发生反应生成偏铝酸钠和氢气.
解答 解:A.镁元素基态原子的核外电子排布式是:1s22s22p63s2 ,故A正确;
B.原子核外有几个电子就有几种不同的运动状态,所以铝原子核外电子有13种运动状态,故B错误;
C.钠离子和铝离子电子层数相同,钠元素离子半径比铝离子半径大,故C正确;
D.金属铝与钠的最高价氧化物的水化物溶液为氢氧化钠溶液,铝和氢氧化钠溶液发生反应生成偏铝酸钠和氢气,反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选B.
点评 本题考查了原子结构,主要是原子电子排布、离子半径大小、物质性质的理解应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | HBr、CO2、H2O、CS2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | NaCl、HCl、H2O、NaOH | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
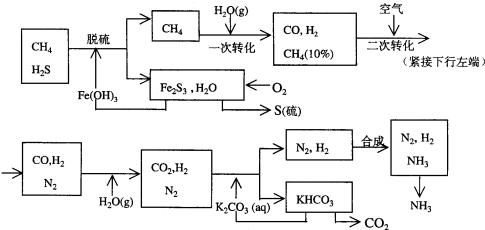
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 37% | ||
| C. | 50% | D. | 数据不全无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
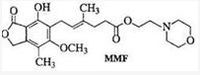
| A. | MMF能发生取代反应和消去反应 | |
| B. | 1 mol MMF能与6 mol 氢气发生加成反应 | |
| C. | 1 mol MMF能与含3 mol NaOH的水溶液完全反应 | |
| D. | MMF可与Na2CO3溶液反应生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体分散质粒子较大,不能透过滤纸 | |
| B. | 液态分散系根据分散质粒子大小分为溶液、胶体和浊液三类 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 纳米材料分散到液体分散剂中的分散系属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸检测,氨水溶液呈碱性:NH3•H2O=NH4++OH- | |
| B. | 100℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13 H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | FeCl3溶液中通入适量SO2,溶液黄色褪去:Fe3++SO2+2H2O=Fe2++SO42-+4H+ | |
| D. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入足量氢氧化钠溶液中:CO2+2OH-=CO32-+H2O | |
| B. | 用小苏打治疗胃酸过多:HCO${\;}_{3}^{-}$+OH-=CO2↑+H2O | |
| C. | 将Cl2通入水中:Cl2+H2O=Cl-+2H++ClO- | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com