
下列各组物质中, 属于强电解质的是 , 属于弱电解质的是
属于非电解质的是 (填字母序号)
A HCl B 硫酸钡 C NH3 D 氢氧化钠 E 淀粉溶液 F 酒精 G 碳酸氢钠 H CH3COOH I Fe J HClO K H2O L SO3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年福建三明一中高一上学期第二次月考化学卷(解析版) 题型:选择题
下列关于浓硝酸和浓硫酸的叙述,正确的是
A.常温下都能用铝制容器贮存
B.露置在空气中,容器内酸液的质量都减轻
C.常温下都能与铜较快地反应
D.露置在空气中,容器内溶质的浓度都升高
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中: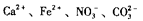
B.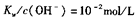 的溶液中:
的溶液中: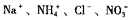
C.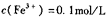 的溶液中:
的溶液中: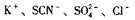
D.由水电离的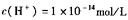 的溶液中:
的溶液中: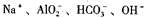
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高二上12月月考化学卷(解析版) 题型:选择题
烷基取代苯 可被酸性高锰酸钾溶液氧化为
可被酸性高锰酸钾溶液氧化为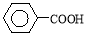 (苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸。据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸。据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有
A.6种 B.7种 C.8种 D. 9种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
室温下,0.1 mol·L-1的HA 溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是
A.原HA溶液中,c(H+)=c(OH-)+c(A-)
B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低
C.当恰好完全中和时,溶液呈中性
D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高二上12月月考化学试卷(解析版) 题型:填空题
25℃,浓度都是1mol•L-1的四种正盐溶液,其pH情况如下:
AX | BX | AY | BY |
pH=7,c(X-)=1mol/L | pH=4 | pH=6 |
(1)AY溶液pH__________7(填“>”、“<”或“=”);
(2)将等浓度的HX、HY稀释相同的倍数,溶液的pH变化幅度:HX__________HY;若将等体积、等 pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH________BOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=_______mol/L;
在AY溶液中:c(A+)-c(Y-)=_________(用一项表示)=_________(用两项表示);
(4)A2Z的水解方程式是_________;_________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省长沙市高三上学期月考化学试卷(解析版) 题型:填空题
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度 /mol.L-1 | 4×10-5 | 6×10-5 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性,试样的pH=_________。
Ⅱ.NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
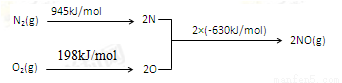
①N2(g)+O2(g) 2NO(g)△H=________。
2NO(g)△H=________。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式___。
2CO(g)═2C(s)+O2(g),已知该反应的△H>0,该设想不能实现,他的依据是_______。
Ⅲ.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
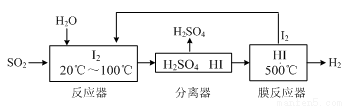
①用离子方程式表示反应器中发生的反应___________________________。
②用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:选择题
工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g) ΔH=+Q KJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为Q kJ
C.将反应的温度由T1升高至T2,则对应温度下的平衡常数K1> K2
D.当反应吸收热量为0.25 Q kJ时,生成的HCl恰好与1 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:选择题
混合下列各组物质使之充分反应,加热蒸干产物并高温下灼烧至质量不变,最终残留固体为纯净物的是( )
A.向CuSO4溶液中加入适量铁粉
B.等物质的量浓度、等体积的FeCl3与KI溶液混合
C.物质的量之比为2:1的NaHCO3与Na2O2溶于水
D.在Na2SiO3溶液中通入过量CO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com