
| A. | NaOH | B. | CuCl2 | C. | CH3COONa | D. | KNO3 |
科目:高中化学 来源: 题型:选择题
| A. | CuCl2[CuSO4] | B. | NaCl[HCl] | C. | NaOH[Na2O] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
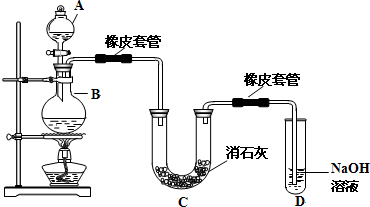
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该服装面料不耐高温 | B. | 羊毛属于合成纤维 | ||
| C. | 羊毛和涤纶可用燃烧法区别 | D. | 加入涤纶可增强面料的耐磨性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
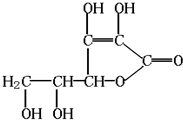
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A(s)的质量 | B. | 混合气体的密度 | ||
| C. | 混合气体的压强 | D. | 混合气的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器压强增大 | B. | 氧气浓度不变 | C. | KO2的量保持不变 | D. | 平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com