
【题目】下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O == Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-== AlO![]() +H2↑
+H2↑
C.金属铝溶于盐酸中:2Al+6H+ == 2Al3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+ == Fe3++H2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
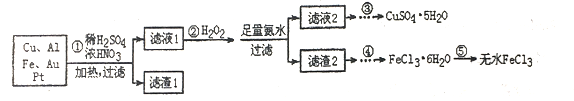
已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为_________________________。
(2)步骤②加H2O2的作用是______________,滤渣2为(填化学式)__________。
(3)步骤⑤不能直接加热脱水的理由是________
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH=________(已知:Ksp[Cu(OH)2]=2.0x10-20)
(5)已知:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080mol·L-1Na2S2O3标准溶液滴定,达到滴定终点的依据是______________。
四次平行实验耗去Na2S2O3标准溶液数据如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
此产品中CuSO4·5H2O的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用下列反应来检查氯气管道是否漏气:3Cl2+8NH3=N2+6NH4Cl,下列说法错误的是
A. 若有白烟产生则管道漏气 B. 该反应中NH4Cl是还原产物
C. 反应中NH3只显还原性 D. 生成1.4gN2时转移0.3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W、N六种元素的原子序数依次增大,其中X、Y、Z、M、W为五种短周期元素。X元素的某种核素无中子,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。N是用量最多的金属元素。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. N的一种氧化物可用作油漆和涂料
C. 热稳定性:XM>X2Z
D. X2Z、WM4分子中各原子最外层均为8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2CNa2S+2CO2↑。其主要流程如下:

(1) 上述流程中采用稀碱液比用热水更好,理由是________________________________________________________________________。
(2) 已知:I2+2S2O32-===2I-+S4O62-。所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1 I2溶液滴定至终点,用去5.00 mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为____________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数,写出计算过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍。下列推断正确的是( )

A. X和Y组成的化合物的水溶液保存在塑料瓶中 B. 原子半径和离子半径均满足:Y<Z
C. 最高价氧化物对应的水化物酸性:Z>T D. 含Z元素的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、l0lkPa下,煤炭、氢气、天然气和甲醇(CH3OH)四种燃料的热值(指一定条件下,单位质量的物质完全燃烧所放出的热量)依次是33kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1。则下列热化学方程式正确的是
A. C(s)+l/2O2(g)=CO(g) △H= -396kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) △H= -286 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -896 kJ·mol-1
D. CH3OH(l)+O2(g)=CO2(g)+2H2O(l) △H= -736 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. H2SO4溶液与氨水反应:H++OH-===H2O
B. CuO与稀盐酸反应:CuO+2H+===Cu2++H2O
C. AlCl3溶液与氢氧化钠溶液反应:AlCl3+3OH-===Al(OH)3↓+3Cl-
D. Cl2与氢氧化钠溶液反应:Cl2+2OH-===2ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。回答下列问题:

(1)在实验室中,欲配制250g70%的浓硫酸,需要的玻璃仪器除量筒、烧杯外,还需要有__________,装置A中盛放浓硫酸的仪器名称是___________。
(2)往三颈烧瓶中通入N2的操作在滴加浓硫酸(填“之前”或“之后”),其目的是______________。
(3)三颈烧瓶中发生反应的化学方程式为_____________________,该反应中浓硫酸表现出的性质为______________。
(4)SO2易溶于水,下列装置可用于C处虚线框内吸收尾气的是___________(填编号)。
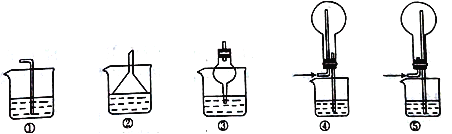
(5)装置B中产生白色沉淀的原因有两种可能。若要证明Fe3+能氧化SO2,则需要改进的地方是___________________,改进后若得到肯定结论,则装置B中发生反应的离子方程式为___________________、____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com