
(1)此白色固体是什么物质?其物质的量是多少?
(2)A、B各为何种物质?其质量分数各为多少?
(1)白色固体是Na2CO3和NaHCO3的混合物,其物质的量分别为0.105 mol 和0.094 mol。
(2)A、B分别为C3H8和C4H10,其质量分数分别为44%和56%。
解析:(1)由题意,可知白色固体为烷烃燃烧生成的CO2与NaOH反应的产物(其中NaOH有可能过量),故有以下几种可能①NaOH、Na2CO3 ②Na2CO3 ③Na2CO3、NaHCO3 ④NaHCO3 n(NaOH)=0.1 L×3.04 mol·L-1=0.304 mol
若与CO2反应后产物只有Na2CO3,则所得固体质量应为:
![]() ×0.304 mol×106 g·mol-1=16.112 g<19.026 g
×0.304 mol×106 g·mol-1=16.112 g<19.026 g
若与CO2反应后产物只有NaHCO3,则所得白色固体的质量应为:
0.304 mol×84 g·mol-1=25.536 g>19.026 g
由此,可知白色固体应为Na2CO3和NaHCO3的混合物。
设其中含Na2CO3 的物质的量为x,NaHCO3 的物质的量为?y?。
则有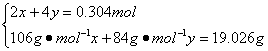
解得:x=0.105 mol y=0.094 mol
(2)由液化气的成分,可知A、B应为C3H8和C4H10。液化气燃烧生成H2O的物质的量为:
n(H2O)=![]() =0.256 mol
=0.256 mol
n(H)=2×0.256 mol=0.512 mol
n(C)=0.105 mol+0.094 mol=0.199 mol
液化气的质量m=0.199 mol×12 g·mol-1+0.512 mol×1 g·mol-1=2.9 g
设m g液化气中含C3H8的物质的量为 a,C4H10 的物质的量为b。
则![]()
解得 a=0.029 mol b=0.028 mol
液化气中含C3H8的质量分数:
![]() ×100%=44%
×100%=44%
C4H10的质量分数:1-44%=56%


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com