
分析 A是有机羧酸盐HCOONa,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2中的一种,由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3,即2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O,故X为H2O,Y为CO2.E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g•L-1,可知气体Z的相对分子质量=0.76×22.4=17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,可确定E是Na3N,由此可解答问题.
解答 解:A是有机羧酸盐HCOONa,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2中的一种,由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3,即2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O,故X为H2O,Y为CO2.E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g•L-1,可知气体Z的相对分子质量=0.76×22.4=17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,可确定E是Na3N,
(1)上述分析可知E为Na3N,含有离子键;故答案为:离子键;
(2)X为H2O,水分子之间存在氢键,沸点高于同主族同类型物质,故答案为:水分子之间存在氢键;
(3)E与X反应的化学方程式为:Na3N+3H2O=3NaOH+NH3↑,故答案为:Na3N+3H2O=3NaOH+NH3↑;
(4)D为Na2CO3,其饱和溶液中不断通入CO2,析出C为NaHCO3,反应的离子方程式为:2Na++CO32-+H2O+CO2=2NaHCO3↓;
故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓;
(5)反应2HCOONa→P+H2↑得到P,P溶液中的阴离子通常用CaC12使之沉淀,由守恒可知P为Na2C2O4,反应中有单质氢气生成,属于氧化还原反应,
故答案为:Na2C2O4;是.
点评 本题考查无机物推断,是对学生综合能力的考查,充分利用题目信息进行推断,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )| A. | 该电池为生物质能的利用提供了一个很好的途径 | |
| B. | 该离子交换膜为质子交换膜 | |
| C. | 电源负极周围溶液的pH值升高 | |
| D. | 碎木屑发生氧化反应:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题:
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题: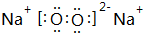 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
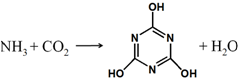 CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含有σ键又含有π键 | ||
| C. | 分子中既含极性键,又含非极性键 | D. | 生成该物质的上述反应为中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳元素是构成有机物的基础元素.
碳元素是构成有机物的基础元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<D<C<B | |
| B. | 最简单氢化物的稳定性:D<C | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类不一定都是高分子化合物,但水解产物相同 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 | |
| C. | 利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中加入足量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 纯碱溶液呈碱性的原因:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Mg 2++2HC03-+Ca 2++2OH -→MgC03↓+CaC03↓+2H20 | |
| B. | Mg 2++2HC03-+2Ca 2++4OH -→Mg(OH)2↓+2CaC03↓+2H20 | |
| C. | Mg 2++3HC03-+3Ca 2++5OH -→Mg(OH)2↓+3CaC03↓+3H20 | |
| D. | Ca2++C032-→CaCO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com