
分析 (1)2K2Cr2O7(橙色)+3CH3CH2OH+8H2SO4→2Cr2(SO4)3(绿色)+3CH3COOH+2K2SO4+11H2O中,Cr元素的化合价降低,C元素的化合价升高;
(2)CuO的氧化性较弱.
解答 解:(1)2K2Cr2O7(橙色)+3CH3CH2OH+8H2SO4→2Cr2(SO4)3(绿色)+3CH3COOH+2K2SO4+11H2O中,Cr元素的化合价降低,则氧化剂为K2Cr2O7,C元素的化合价升高,则还原剂为CH3CH2OH,故答案为:K2Cr2O7;CH3CH2OH;
(2)装置中的K2Cr2O7不能该用CuO来替代,因CuO的氧化性较弱,只能将乙醇氧化为乙醛,故答案为:不能,CuO的氧化性较弱.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化性的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构. ,CB2的电子式为
,CB2的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
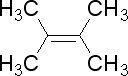 ,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为CH3C≡CCH3.
,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为CH3C≡CCH3. 与CH3C≡CNa反应:
与CH3C≡CNa反应: +CH3C≡CNa→NaBr+
+CH3C≡CNa→NaBr+ ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有O2 | B. | 只有O2、SO3 | ||
| C. | 只有O2、SO2 | D. | SO2、O2、SO3中都有 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能
B.化学反应不一定都有能量变化
C.活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响
D.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列有关气体摩尔体积的说法中正确的是
A.在标准状况下,1 mol任何物质的体积都约为22.4 L
B.在标准状况下 ,0.5 mol任何气体的体积都约为11.2 L
,0.5 mol任何气体的体积都约为11.2 L
C.在常温常压下,1 mol任何气体的体积都约为22.4 L
D.在标准状况下,0.5 mol CCl4所占有的体积约为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com