
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
分析 (1)等pH的酸,其电离程度越大,酸的物质的量浓度越小;
(2)等pH的酸,其电离程度越大,酸的物质的量浓度越小,等体积时浓度越大,产生的氢气的体积越大;
(3)根据盐类的水解考虑溶液的酸碱性,终点时生成的是醋酸钠,醋酸钠溶液中氢离子为水电离的;
(4)依据同粒子效应,一水合氨对铵根离子水解起到抑制作用,水解程度减小,则水的电离平衡逆移;依据一水合氨的电离平衡常数计算得到氨水浓度..
解答 解:(1)等pH的酸,其电离程度越大,则需要的酸的物质的量浓度越小,根据表中数据可知,电离程度大小为:③<②<④<①,则物质的量浓度由大到小的顺序是③>②>④>①;
故答案为:③>②>④>①;
(2)等体积pH=1的上述几种溶液中,酸中能够产生氢气的氢原子的物质的量由大到小的顺序为:③②①④,则生成氢气的体积由大到小为:③>②>①>④,
故答案为:③>②>①>④;
(3)NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,醋酸钠溶液中的氢离子是水电离的,溶液的pH=a,则溶液中水电离的氢离子=10-amol/L,
故答案为:10-amol/L;
(4)将a mol NH4NO3溶于水,溶液显酸性,是因为铵根离子水解,加入氨水溶液抑制铵根离子水解,水解程度减小,则水的电离平衡逆向进行;将a mol NH4NO3溶于水,向该溶液滴加b L 氨水后溶液呈中性,依据电荷守恒计算可知,溶液中氢氧根离子浓度=10-7mol/L,c(NH4+)=c(NO3-);NH3•H2O的电离平衡常数取Kb=2×10-5 mol•L-1,设混合后溶液体积为1L,(NH4+)=c(NO3-)=amol/L;根据一水合氨电离平衡得到:NH3•H2O?NH4++OH-,平衡常数K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{amol/L×1{0}^{-7}mol/L}{bL×c(N{H}_{3}•{H}_{2}O)mol/L}$=2×10-5 mol•L-1,计算得到c(NH3•H2O)=$\frac{a}{200b}$mol/L,
故答案为:逆向;$\frac{a}{200b}$.
点评 本题考查了酸碱混合的定性判断、溶液中离子浓度定性、电离平衡常数的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、盐的水解判断溶液中离子浓度定性.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. 生成A的化学方程式为
生成A的化学方程式为 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$ +HCHO.
+HCHO. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.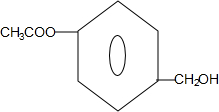 (任写一种结构简式).
(任写一种结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{c(C{O}_{3}^{2-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$ | B. | K=$\frac{c(C{O}_{3}^{2-}){c}^{2}({H}^{+})}{c({H}_{2}C{O}_{3})}$ | ||
| C. | K1=$\frac{c(HC{O}_{3}^{-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$ | D. | K2=$\frac{(C{O}_{3}^{2-})c({H}^{+})}{c(HC{O}_{3}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1的盐酸中,含HCl分子数为NA | |
| B. | 0.1mol Na2O2与水完全反应,转移0.2NA个电子 | |
| C. | 8.4gNaHCO3固体中含HCO3-数目为0.1NA | |
| D. | 将含Na+数目为NA的NaCl固体溶于1L水中,所得溶液的浓度为1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com