
【化学—物质结构与性质】(13分)
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
A.配位键
B.极性键
C.离子键
D.非极性键
E.氢键
F.金属键
(5)CuCl的晶胞结构如图所示,其中Cl-的配位数(即与Cl- 最近距离的Cu+的个数)为 。

(1)3d9;O>N>H;(2)V型
(3)sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)4;ABD;(5)4
【解析】
试题分析:(1)配离子[Cu(En)2]2+的中心原子是铜离子,则铜离子的基态外围电子排布式为3d9;电负性随电子层数的增大而减小,随核电荷数的增多而增大,H、N、O三种元素中,O的电负性最大,其次是N,H的电负性最小,则H、N、O三种元素的电负性由大到小的顺序是O>N>H;
(2)SO2中S的最外层价电子对数是2+1/2(6-4)=3,有一对孤对电子,所以空间构型是V型;
(3)根据乙二胺的结构简式,N原子周围有3个共价单键,有1对孤对电子,所以N原子是sp3杂化;乙二胺分子间的氨基之间可以形成氢键,使沸点升高,而三甲胺分子间不能形成氢键,所以乙二胺比三甲胺的沸点高的多;
(4)铜离子为+2价,与氨基形成4个配位键,所以其配位数是4;根据配离子的结构式可知在乙二胺中存在碳碳之间的非极性键,C与H,N与H,C与N之间的极性键,还有N与Cu之间的配位键,所以答案选ABD;
(5)每个氯离子周围与Cl- 最近距离的Cu+与氯离子形成正四面体,所以与Cl- 最近距离的Cu+的个数是4,即配位数是4.
考点:考查物质结构与性质的应用


科目:高中化学 来源:2014-2015湖南省娄底市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
2A(g)+B(g) 3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.V(A) = 0.7mol·L-1·min-1
B.V(B) = 0.3mol·L-1·min-1
C.V(C) = 0.9mol·L-1·min-1
D.V(D) = 1.1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是:
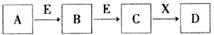
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:填空题
选考(13分)【有机化学基础】
A是一种重要的化工原料,已知A是一种卤代烃相对分子质量为92.5,其核磁共振氢谱中只有一个峰,C是一种高分子化合物,M是一种六元环状酯,转化关系如图所示,回答下列问题:

(1)A的分子式为 ;A→B的反应类型 ;
(2)有机物D的结构式为 。 M的结构简式为 。
(3)写出下列反应的化学方程式:
B→C: ;
E→F: 。
(4)写出满足下列条件的H的同分异构体d的结构简式 。
①属于酯类;
②能发生银镜反应;
③能与金属钠反应放出气体。
④核磁共振氢谱有三个峰,且峰面积比为6:1:1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:选择题
下列溶液中粒子的物质的量浓度关系正确的是
A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
TESLA电动汽车的电池采用了松下提供的NCA系列(镍钴铝体系)的18650A型钴酸锂(LiCoO2)锂离子电池。电池正极材料为钴酸锂(LiCoO2),负极材料是石墨(C6)。电池反应为: LiCoO2+C6 C6Lix+Li1-xCoO2。下列有关说法不正确的是
C6Lix+Li1-xCoO2。下列有关说法不正确的是
A.锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点
B.废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收
C.放电时,正极锂的化合价未发生改变
D.充电时电池正极上发生的反应为:LiCoO2—x e-=== Li1-x CoO2+xLi+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2 SO4(s) 能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:[N(CH3)4]2 SO4(s)+ SO2(g) [N(CH3)4]2 S2O6(s)下列说法正确的是
[N(CH3)4]2 S2O6(s)下列说法正确的是
A.[N(CH3)4]+中只含共价键
B.该反应中,SO2作氧化剂
C.SO2漂白品红是利用其强氧化性
D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)金属腐蚀一般可分为化学腐蚀和 腐蚀。
(2)炒过菜的铁锅未及时洗净容易发生腐蚀。
①若铁锅内残液呈弱酸性,则腐蚀属于 (填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应属于 腐蚀。
②吸氧腐蚀中,负极的电极反应式为 。
铁锈中铁的化合价为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com