
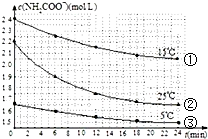
 ��֪��������立�����ˮ�ⷴӦΪ��NH2COONH4+2H2O?NH4HCO3+NH3•H2O��ij�о�С��õ�c��NH2COO-����ʱ��仯������ͼ��ʾ�������й�˵��һ����ȷ���ǣ�������
��֪��������立�����ˮ�ⷴӦΪ��NH2COONH4+2H2O?NH4HCO3+NH3•H2O��ij�о�С��õ�c��NH2COO-����ʱ��仯������ͼ��ʾ�������й�˵��һ����ȷ���ǣ�������| A�� | �ԱȢ���ۣ���֪Ũ��Խ��ˮ������Խ�� | |
| B�� | �ԱȢ���ڣ���֪�¶�Խ��ˮ������Խ�� | |
| C�� | ��ˮϡ�ͣ�ƽ��������Ӧ�����ƶ���Kֵ���� | |
| D�� | ����������ڼ��������±�������������ˮ��̶ȴ� |
���� A�������¶ȢٱȢ۴�Ũ�ȢٱȢ�Ҳ�������
B�����ݢ�25�淴Ӧ����ʼŨ�Ƚ�С����0��6min��ƽ����Ӧ���ʣ����ߵ�б�ʣ��ԱȢ�15��������
C��ƽ�ⳣ�������¶��йأ�
D������NH2COONH4+2H2O?NH4HCO3+NH3•H2O���ڼ���������ƽ�������ƶ����ݴ˷�����
��� �⣺A����Ȼ��0��6min��ƽ����Ӧ���ʣ����ߵ�б�ʣ��ٱȢ۴��Ǣٵ��¶�Ҳ�Ȣ۸ߣ����Բ��ܵó�Ũ��Խ��ˮ������Խ�죬��A����
B�����25�淴Ӧ����ʼŨ�Ƚ�С����0��6min��ƽ����Ӧ���ʣ����ߵ�б�ʣ��ԱȢ�15������Կ�֪�¶�Խ��ˮ������Խ�죬��B��ȷ��
C����Ϊƽ�ⳣ�������¶��йأ����Լ�ˮϡ�ͣ�ƽ��������Ӧ�����ƶ���Kֵ���䣬��C����
D����NH2COONH4+2H2O?NH4HCO3+NH3•H2O���ڼ���������ƽ�������ƶ�������������ƽ�������ƶ��������ڼ��������±�������������ˮ��̶�С����D����
��ѡB��
���� ���⿼����ͼ������ж��Լ�ƽ�ⳣ����ƽ���ƶ����жϣ�Ũ�ȱ仯���ɵķ����ж��ǽ���ؼ�����Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 100 g��������Ϊ98%��Ũ�����������е���ԭ����Ϊ4 NA | |
| B�� | ������Fe��6.72 L Cl2��Ӧת�Ƶĵ�����Ϊ0.6 NA | |
| C�� | �ܱ�������1 molN2��4 molH2��Ӧ���ɵ�NH3������С��2NA | |
| D�� | ���³�ѹ�£�92 g��NO2��N2O4������庬�е���ԭ����Ϊ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���������Ӽ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ
���������Ӽ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ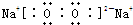 �����м��Թ��ۼ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ
�����м��Թ��ۼ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �淴Ӧ������������Ӧ���ʼ�С��ƽ�����淴Ӧ�����ƶ� | |
| B�� | �淴Ӧ���ʼ�С������Ӧ��������ƽ��������Ӧ�����ƶ� | |
| C�� | �����淴Ӧ���ʶ�����ƽ��������Ӧ�����ƶ� | |
| D�� | �����淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 һ�������£������Ϊ3L���ܱ������У�CO��H2��Ӧ���ɼ״���CH3OH��������ΪCu2O/ZnO����CO��g��+2H2��g��?CH3OH��g����������и��⣺
һ�������£������Ϊ3L���ܱ������У�CO��H2��Ӧ���ɼ״���CH3OH��������ΪCu2O/ZnO����CO��g��+2H2��g��?CH3OH��g����������и��⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ɫ����Һ�У�K+��Na+��MnO4-��SO42- | |
| B�� | ��pH=11����Һ�У�CO32-��Na+��NO3-��SO42- | |
| C�� | ˮ�������c��H+��=10-12mol•L?1����Һ�У�Cl-��HCO3-��NO3-��NH4+ | |
| D�� | ��������Һ�У�Na+��NH4+��SO42-��S2O32- |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com