
| A. | 含有大量Cl-的溶液中肯定不存在Ag+ | |
| B. | AgI悬浊液中加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中逐渐加入KI固体至c(I-)=$\frac{{K}_{sp}(AgI)}{{K}_{sp}(AgCl)}$mol•L-1时,AgCl开始向AgI沉淀转化 | |
| D. | 向浓度均为0.01 mol•L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol•L-1 |
分析 A.一般认为离子浓度为10-5mol•L-1时沉淀完全;
B.加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,c(I-)浓度增大,c(Ag+)减小,但引入K+;
C.发生AgCl(s)+I-(aq)?AgI(s)+Cl-(aq),K=$\frac{{K}_{sp}(AgCl)}{{K}_{sp}(AgI)}$;
D.当Cl-开始沉淀时,c(Ag+)=$\frac{1.6×1{0}^{-10}}{0.01}$=1.6×10-8mol/L,溶液中I-的浓度为$\frac{2.0×1{0}^{-16}}{1.6×1{0}^{-8}}$.
解答 解:A.一般认为离子浓度为10-5mol•L-1时沉淀完全,则含有大量Cl-的溶液中,肯定存在少量的Ag+,故A错误;
B.加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,c(I-)浓度增大,c(Ag+)减小,但引入K+,则离子的总浓度会增大,故B错误;
C.发生AgCl(s)+I-(aq)?AgI(s)+Cl-(aq),K=$\frac{{K}_{sp}(AgCl)}{{K}_{sp}(AgI)}$,则$\frac{c(C{l}^{-})}{c({I}^{-})}$<$\frac{{K}_{sp}(AgCl)}{{K}_{sp}(AgI)}$时正向移动,即c(I-)=$\frac{{K}_{sp}(AgI)}{{\sqrt{Ksp(AgCl)}}_{\;}}$mol•L-1时,AgCl开始向AgI沉淀转化,故C错误;
D.当Cl-开始沉淀时,c(Ag+)=$\frac{1.6×1{0}^{-10}}{0.01}$=1.6×10-8mol/L,溶液中I-的浓度为$\frac{2.0×1{0}^{-16}}{1.6×1{0}^{-8}}$=1.25×10-8 mol•L-1,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、溶解平衡移动、沉淀转化为解答的关键,侧重分析与应用能力的考查,注意K的计算,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 平均反应速度:乙>甲 | B. | 平衡时nc(甲)>nc(乙) | ||
| C. | 平衡时C的转化率:甲>乙 | D. | 平衡时A的物质的量甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
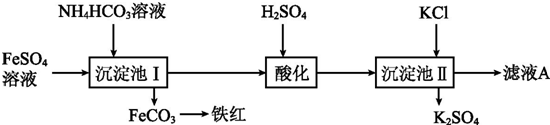
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )| A. | Ag2CO3的Ksp为8.1×10-12 | |
| B. | Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)平衡常数K=2.5×108 | |
| C. | 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点) | |
| D. | 在0.001mol•L-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol•L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
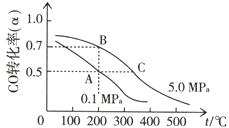 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com