
| A. | CH4 | B. | C4H10 | C. | C5H12 | D. | C8H18 |
分析 烷烃只能生成一种一氯化物,则分子中含有1种H原子,说明结构对称,分子中只含有甲基,以此解答该题.
解答 解:A.CH4只有一种结构,只有一种氢原子,所以一氯代物有1种,故A不选;
B.C4H10有正丁烷和异丁烷,正丁烷(CH3CH2CH2CH3)有2种氢原子,所以一氯代物有2种;异丁烷CH3CH(CH3)CH3有2种氢原子,所以一氯代物有2种,故B选;
C.戊烷有正戊烷、异戊烷、新戊烷3种同分异构体,正戊烷CH3CH2CH2CH2CH3有3种氢原子,所以一氯代物有3种;异戊烷CH3CH(CH3)CH2CH3有4种氢原子,所以一氯代物有4种;新戊烷CH3C(CH3)2CH3有1种氢原子,所以一氯代物有1种,故C不选;
D.C8H18的一种结构是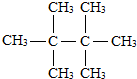 有1种氢原子,所以一氯代物有1种,故D不选.
有1种氢原子,所以一氯代物有1种,故D不选.
故选B.
点评 本题考查有机物的结构,为高频考点,侧重考查同分异构体的判断,难度较大,先确定烃的同分异构体,再确定等效氢原子,最后根据氢原子的种类确定一氯代物的种类,会确定等效氢原子是解本题的关键.


科目:高中化学 来源: 题型:填空题
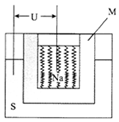 如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx.该电池正极的电极反应式为xS+2e-=Sx2-.
如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx.该电池正极的电极反应式为xS+2e-=Sx2-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g | B. | 11.2 g | C. | 5.6 g | D. | 8.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用敞口容器称量NaOH且时间过长 | |
| B. | 定容时俯视读取刻度 | |
| C. | 原容量瓶洗净后未干燥 | |
| D. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
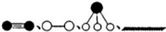 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示: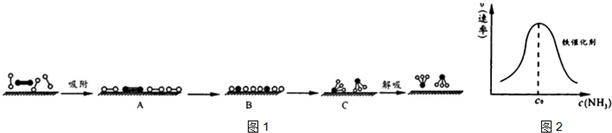
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
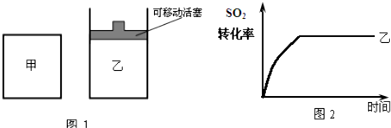
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
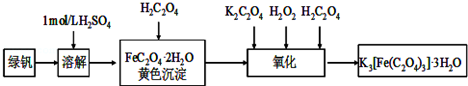
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com