
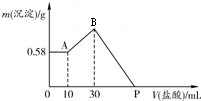
 将NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加0.4mol?L-1的盐酸,加入盐酸的体积和沉淀质量的变化关系如下图所示.下列说法错误的是( )
将NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加0.4mol?L-1的盐酸,加入盐酸的体积和沉淀质量的变化关系如下图所示.下列说法错误的是( )| A、最初10 mL盐酸用于中和过量的NaOH溶液 | B、混合物中AlCl3的物质的量为0.008 mol | C、混合物中NaOH的质量为2.24 g | D、P点所示加入盐酸的体积为110 mL |
| 0.58g |
| 58g/mol |
| 0.056mol |
| 0.4mol/L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
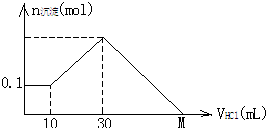 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,右图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,右图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )| A、70mL | B、100mL | C、120mL | D、130mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
将NaOH,MgCl2,AlCl3三种固体组成的混合物溶于足量水, 产生1.16g白色沉淀, 再向所得浊液中逐渐加入1.00 mol/L的盐酸, 加入盐酸的体积与生成沉淀的关系如下图:

请回答:①A点化学式____________,理由_______________
②写出A到B发生反应的离子方程式_______________________
③原混合物中MgCl2质量是_________g, AlCl3质量是_________g, NaOH质量是_________g
④C点消耗盐酸的体积为_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com