
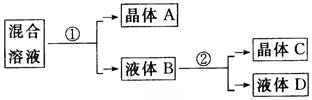
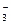 的溶液中提取KNO3,应该采取冷却热饱和溶液的方法。而原溶液可能是不饱和的(对KNO3而言)、低温的。欲冷却,应制成高温的;欲使KNO3饱和,要蒸发水分——此为操作①。高温(100℃)下蒸发水,溶解度小者就会首先析出(NaCl)——此为A主要成分。过滤出NaCl晶体,然后冷却的饱和溶液——此即操作②,可析出晶体——主要是KNO3,也含有少量NaCl——C的主要成分。进行再结晶可提纯KNO3。
的溶液中提取KNO3,应该采取冷却热饱和溶液的方法。而原溶液可能是不饱和的(对KNO3而言)、低温的。欲冷却,应制成高温的;欲使KNO3饱和,要蒸发水分——此为操作①。高温(100℃)下蒸发水,溶解度小者就会首先析出(NaCl)——此为A主要成分。过滤出NaCl晶体,然后冷却的饱和溶液——此即操作②,可析出晶体——主要是KNO3,也含有少量NaCl——C的主要成分。进行再结晶可提纯KNO3。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:不详 题型:单选题
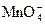 +10Cl-+16H+====2Mn2++5Cl2↑+8H2O ②2Fe3++2I-====2Fe2++I2 ③2Fe2++Cl2====2Fe3++2Cl-。某溶液中含有Cl-和I-,为了氧化I-而不使Cl-被氧化,可选用的氧化剂是
+10Cl-+16H+====2Mn2++5Cl2↑+8H2O ②2Fe3++2I-====2Fe2++I2 ③2Fe2++Cl2====2Fe3++2Cl-。某溶液中含有Cl-和I-,为了氧化I-而不使Cl-被氧化,可选用的氧化剂是| A.FeCl2 |
| B.浓盐酸 |
| C.KMnO4 |
| D.FeCl3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.②①③⑤④ |
| B.②③①⑤④ |
| C.①②③④⑤ |
| D.⑤④③②① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入AgNO3溶液生成的白色沉淀不溶于稀盐酸,则原溶液中一定有Cl-存在 |
| B.加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在 |
| C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+存在 |
| D.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量CO32-存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+ |
| B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明有I- |
| C.往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32— |
| D.往溶液中加入 BaC12溶液和稀 HNO3 ,有白色沉淀生成,说明有SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.被测样品中含有加热不挥发的杂质 | B.被测样品中含有加热易挥发的杂质 |
| C.实验前被测样品已有部分失水 | D.加热前所用的坩埚未完全干燥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

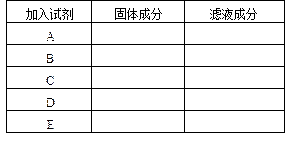
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用一种试剂 | B.用二种试剂 | C.用三种试剂 | D.不用任何试剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com