
(8分)某课外活动小组同学用右图装置进行实验,试回答下列问题。
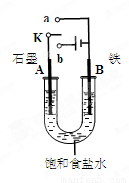
(1)若开始时开关K与b连接,则B极的电极反应式为________________________
总反应的离子方程式为________________________。
有关上述实验,下列说法正确的是(填序号)________________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为________________。
(8分,每空2分)(1)2H-+2e-=H2↑(或2H2O+2e-=H2↑+2OH-)
2Cl-+2H2O Cl2+H2↑+2OH-
②④(各1分,多选倒扣,扣完为止)
Cl2+H2↑+2OH-
②④(各1分,多选倒扣,扣完为止)
(2)Fe-2e-=Fe2+
【解析】(1)若开始时开关K与b连接,则构成电解池。B与电源的负极相连,作阴极,溶液中的氢离子放电,反应式为2H-+2e-=H2↑。电解饱和食盐水的总反应式为2Cl-+2H2O Cl2+H2↑+2OH-。电解池中阴极失去电子,所以溶液中的阳离子向阴极移动,A是阳极,①不正确。阳极A是氯离子放电,生成氯气,氯气能把碘化钾氧化生成碘单质,②正确。由于从溶液中出来的是氢气和氯气,所以应该再加入氯化氢气体可恢复到电解前电解质相同的状态,③不正确。根据阴极的电极反应式可知,生成0.1mol氢气,转移电子是0.2mol,④正确。答案选②④。
Cl2+H2↑+2OH-。电解池中阴极失去电子,所以溶液中的阳离子向阴极移动,A是阳极,①不正确。阳极A是氯离子放电,生成氯气,氯气能把碘化钾氧化生成碘单质,②正确。由于从溶液中出来的是氢气和氯气,所以应该再加入氯化氢气体可恢复到电解前电解质相同的状态,③不正确。根据阴极的电极反应式可知,生成0.1mol氢气,转移电子是0.2mol,④正确。答案选②④。
(2)若开始时开关K与a连接,则构成原电池,铁是负极,发生吸氧腐蚀,负极反应式为Fe-2e-=Fe2+。


科目:高中化学 来源: 题型:
 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
(2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
| ||
| ||
 气、氧气、硫酸和氢氧化钾.
气、氧气、硫酸和氢氧化钾.查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组同学用右图装置进行实验,试回答下列问题.
某课外活动小组同学用右图装置进行实验,试回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com