
下列说法正确的是:
A、过量的铁在氯气中燃烧可生成氯化亚铁
B、向Fe(NO3)2溶液加入盐酸,由于酸性增强抑制Fe2+的水解,使c(Fe2+)增大
C、Fe和Fe2O3的混合物溶于盐酸中,再加入KSCN溶液,溶液一定变为血红色
D、把一定量的铁和铜的混和粉未投入到FeCl3溶液中,不可能出现只有铁剩余没有铜剩余的情况
D
【解析】
试题分析:由于Cl2强氧化性,与铁反应不论过量与否均生成氯化铁,故A错误;向Fe(NO3)2溶液加入盐酸,酸性条件下的硝酸根具有强氧化性,会氧化Fe2+为Fe3+,溶液中C(Fe2+)减小,故B项错误;Fe和Fe2O3的混合物溶于盐酸中,Fe和Fe3+会发生氧化还原反应Fe+ 2Fe3+==3 Fe2+,若溶液中恰好为Fe2+,加入KSCN溶液,溶液不变为血红色,故C项错误;把一定量的铁和铜的混和粉未投入到FeCl3溶液中,铁的还原性强于铜,所以若有铁剩余,则铜一定未参与反应,必然会剩余,所以不可能出现只有铁剩余没有铜剩余的情况,故D项正确。
考点:铁及其化合物知识


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
下列实验方案不可行或结论不正确的是
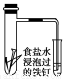
A.用湿润的pH试纸测定饱和Na2CO3溶液的pH
B.通过观察图中导管水柱的变化,验证铁钉生锈的主要原因是吸氧腐蚀
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2
D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积,比较两种酸的电离程度:醋酸<盐酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:填空题
(13分)
Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32 -),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
已知常温下,AgBr的Ksp=4.9×10-13 mol2·L-2、AgI的Ksp=8.3×10-17 mol2·L-2 下列说法正确的是:
A.常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数
B.常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17mol2·L-2
C.常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14 mol/L
D.向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.CuSO4·5H2O是一种化合物
B.分散系一定是混合物
C.碱性氧化物不一定是金属氧化物
D.氯化银、冰醋酸、酒精、水银分别属于强电解质、弱电解质、非电解质、既不是电解质也不是非电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:填空题
(11分)A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如下图所示(部分产物已略去)

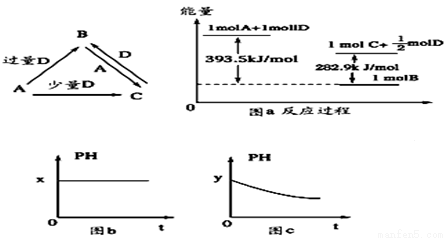
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为____________。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则①C的化学式为________________。
②反应B+A→C的离子方程式为____________________________。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)
①若图b符合事实,则D为________(填化学式),此时图b中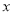 ________7(填“﹥”“﹤”“=”)。若图c符合事实,则其pH变化的原因是_____________(用离子方程式表示)。
________7(填“﹥”“﹤”“=”)。若图c符合事实,则其pH变化的原因是_____________(用离子方程式表示)。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出1molA和D反应生成C的反应热为ΔH=________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
下列反应与Na2O2+SO2==Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+2CO2==2Na2CO3+O2↑ B.2Na2O2+2SO3==2Na2SO4+O2↑
C.Na2O2+H2SO4==Na2SO4+H2O2 D.3Na2O2+Cr2O3==2Na2CrO4+Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.摩尔是七个基本物理量之一 |
| B.阿伏伽德罗常数是没有单位的 |
| C.氮气的摩尔质量是28g |
| D.1molH2O约含有6.02×1023个水分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com