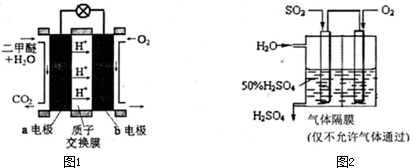
CO和H
2是合成多种有机化合物的重要原料,亦称作合成气.CO和H
2反应在不同条件下得到不同的产物:
| 反应条件 |
主要产物 |
生成1mol有机物
△H/kJ?mol-1 |
| Cu-ZnO-Cr2O3-MnO,200~400℃,30~40MPa |
甲醇 |
-128 |
| Ni,250~500℃,常压 |
甲烷(和水蒸气) |
-206.2 |
| FeO-Co-Ni,150~350℃,0.1~3MPa |
人造石油 |
|
| Ru,150~250℃,10~100MPa |
固态烷烃 |
|
| ThO-ZnO-Al2O3,400~500℃,10~100MPa |
异丁烷、异戊烷 |
|
| Co-Fe,100~200℃,10~20MPa |
含氧有机化合物 |
|
| Rh原子簇配合物,高压液相 |
乙二醇
(少量乙酸、乙醇) |
|
现有可以由CO和H
2在不同条件下合成的A、C、G三种有机化合物,这三种化合物在上表中都已列出.它们及相关的其他物质有如下的转化关系:

已知:常温常压下,A、B、D均为气态,E和F是同分异构体,将等质量的D和E分别完全燃烧消耗氧气的量、生成二氧化碳和水的量两者都相同.请回答下列问题:
(1)写出D和H的结构简式:D
,H
;写出由B生成C的反应类型
.
(2)G与过量金属钠反应的化学方程式为
.
(3)F的银镜反应为
.
(4)C可用作燃料电池的燃料,在碱性溶液中此电池负极的电极反应为
.
(5)A与水蒸气在一定条件下反应生成合成气CO和H
2,其热化学方程式为(注明催化剂)
,为了有利于合成气的生成,压强不采用高压而采用常压的原因是
,温度应高于
.




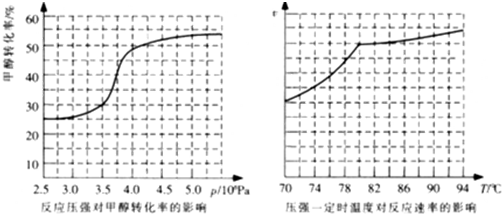
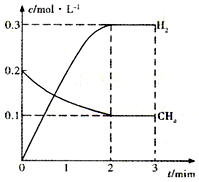 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.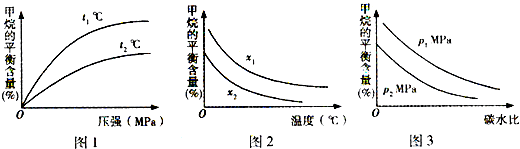
 煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.