
| A. | 1s 2p 3s 3d | B. | 2s 2px 2py 2pz | C. | 1s 3s 3d 4s | D. | 4f 3p 2p 1s |
分析 各能级能量高低顺序为①相同n而不同能级的能量高低顺序为:ns<np<nd<nf,②n不同时的能量高低:2s<3s<4s 2p<3p<4p;③不同层不同能级ns<(n-2)f<(n-1)d<np,④同一能级上的原子轨道具有相同的能量:npx=npy=npz,以此解答该题.
解答 解:各能级能量高低顺序为①相同n而不同能级的能量高低顺序为:ns<np<nd<nf,②n不同时的能量高低:2s<3s<4s 2p<3p<4p;③不同层不同能级ns<(n-2)f<(n-1)d<np,绝大多数基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f…
A.由以上分析可知各轨道能量由低到高排列:1s<2p<3s<3d,故A正确;
B.2px 2py 2pz轨道是3个不同的原子轨道,空间伸展方向不同,3个轨道上的电子的运动状态不同,但同一能级上的原子轨道具有相同的能量,2S<2px=2py=2pz,故B错误;
C.由以上分析可知各轨道能量由低到高排列:1s<3s<4s<3d,故C错误;
D.由以上分析可知各轨道能量由低到高排列:1s<2p<3p<4f,故D错误;
故选A.
点评 本题考查核外电子的排布,题目难度中等,注意根据构造原理把握能量大小的排布顺序,为解答该题的关键之处.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
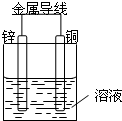 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
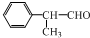 ,工业合成路线如下:
,工业合成路线如下: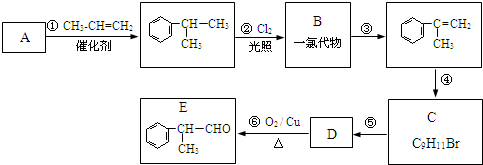
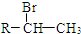
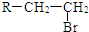 .(R-代表烃基)
.(R-代表烃基)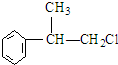 、
、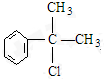 ;
;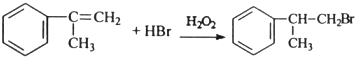 ;
;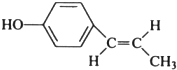 (只写反式结构).
(只写反式结构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗不能与强碱溶液反应 | B. | 氢氧化锗有两性 | ||
| C. | 氧化锗易溶于水 | D. | 氧化锗的化学式为Ge2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部蕴储着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 物质的化学能可以在不同条件下转为热能、电能为人类所利用 | |
| D. | 我国经济发展要全部依靠化石能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com