
| A. | 正极附近的SO42-浓度逐渐增大 | B. | 电子通过导线由铜片流向锌片 | ||
| C. | 正极有O2逸出 | D. | 铜片上有H2逸出 |
分析 该原电池中,较活泼的金属锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应生成氢气;电子从负极沿导线流向正极;溶液中阴离子向负极移动,阳离子向正极移动,据此分析.
解答 解:A、原电池放电时,溶液中阴离子向负极移动,所以负极附近的SO42-浓度逐渐增大,故A错误;
B、原电池放电时,电子从负极沿导线流向正极,即电子通过导线由锌片流向铜片,故B错误;
C、正极上氢离子得电子生成氢气,有H2逸出,故C错误;
D、铜片作正极,正极上氢离子得电子生成氢气,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,难点是判断溶液中阴阳离子的移动方向,很多学生认为阴离子向正极移动,阳离子向负极移动.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
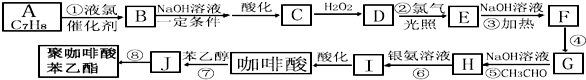
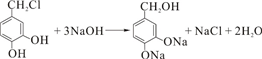
 是一种环保型的新涂料,其合成路线如图所示:请回答下列问题:
是一种环保型的新涂料,其合成路线如图所示:请回答下列问题:
 .
. .
. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式). CH2CH=CH2合成B的另一种途径为:
CH2CH=CH2合成B的另一种途径为: CH2CH=CH2$\stackrel{Cl_{2}+CCl_{4}}{→}$F$→_{△}^{NaOH溶液}$H$\stackrel{氧化}{→}$
CH2CH=CH2$\stackrel{Cl_{2}+CCl_{4}}{→}$F$→_{△}^{NaOH溶液}$H$\stackrel{氧化}{→}$ $→_{一定条件}^{G}$
$→_{一定条件}^{G}$ ,试剂G的化学式H2.
,试剂G的化学式H2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
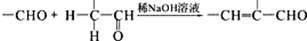 ;
; 
 .
.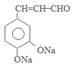 +2Ag(NH3)2OH$\stackrel{水浴}{→}$
+2Ag(NH3)2OH$\stackrel{水浴}{→}$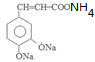 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.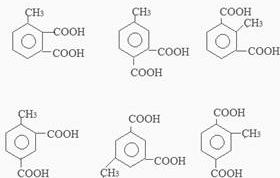 (任三种).
(任三种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | DABC | B. | DCAB | C. | BADC | D. | ABCD |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

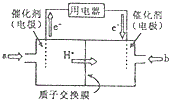
| A. | 燃料电池工作时,负极反应为:H2-2e-=2H+ | |
| B. | 若要实现铁上镀铜,则a极是铁,b极是铜 | |
| C. | 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,在相同条件下当电池中消耗H2 22.4 L(标准状况)时,a极析出铜64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸(乙酸钠、水):加入硫酸,后结晶、过滤 | |
| B. | 乙酸乙酯(乙酸):加入饱和碳酸钠溶液,后分液 | |
| C. | 苯(苯酚):加入浓溴水,后过滤 | |
| D. | 氢氧化铁胶体(FeCl3):渗析 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com