
【题目】已知A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均已略去。

(1)写出它们的化学式:A________、C________、J________。
(2)实验室制备气体B的化学方程式为_____________________。
(3)写出B+D―→E+F的化学方程式:_______________________________________________。
(4)J的浓溶液与单质Ag反应的离子方程式为__________________________________。
【答案】 NH4Cl HCl HNO3 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 4NH3+5O2
CaCl2+2NH3↑+2H2O 4NH3+5O2![]() 4NO+6H2O Ag + 2H++NO
4NO+6H2O Ag + 2H++NO![]()
![]() Ag++ NO2↑+H2O
Ag++ NO2↑+H2O
【解析】本题考查无机推断题,I是红棕色气体,即I为NO2,E为气体,接触空气生成红棕色气体NO2,即E为NO,D为O2,I和F反应生成J和NO,且F常温下为无色液体,即F为H2O,J为HNO3,H为黄绿色气体,即H为Cl2,与水反应:Cl2+H2O=HCl+HClO,K光照下生成C和D,发生2HClO![]() 2HCl+O2↑,C为HCl,反应①:B和O2反应生成NO和H2O,即B为NH3,A受热分解为NH3和HCl,即A为NH4Cl,(1)根据上述分析,A为NH4Cl,C为HCl,J为HNO3;(2)实验室制备氨气,用NH4Cl固体和Ca(OH)2固体加热制备,反应方程式为:2NH4Cl+Ca(OH)2
2HCl+O2↑,C为HCl,反应①:B和O2反应生成NO和H2O,即B为NH3,A受热分解为NH3和HCl,即A为NH4Cl,(1)根据上述分析,A为NH4Cl,C为HCl,J为HNO3;(2)实验室制备氨气,用NH4Cl固体和Ca(OH)2固体加热制备,反应方程式为:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;(3)反应①是氨的催化氧化,即反应方程式为:4NH3+5O2
CaCl2+2NH3↑+2H2O;(3)反应①是氨的催化氧化,即反应方程式为:4NH3+5O2 ![]() 4NO+6H2O;(4)Ag和浓硝酸反应:Ag+2H++NO3-
4NO+6H2O;(4)Ag和浓硝酸反应:Ag+2H++NO3-![]() Ag++NO2↑+H2O。
Ag++NO2↑+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】表中对相关物质的分类全部正确的一组是 ( )。
选项 | 纯净物 | 混合物 | 弱电解质 | 非电解质 |
A | 明矾 | 蔗糖 | NaHCO3 | CO2 |
B | 天然橡胶 | 生石膏 | SO2 | CH3CH2OH |
C | 王水 | 冰 | H2SiO3 | Cl2 |
D | 胆矾 | 玻璃 | H2CO3 | NH3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016福建卷】 [化学-物质结构与性质]科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为________________。
(2)下列关于CH4和CO2的说法正确的是_______(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.
①基态Ni原子的电子排布式为_______,该元素位于元素周期表的第_____族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_______molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。

①“可燃冰”中分子间存在的2种作用力是________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示,回答下列问题:

(1)按要求写出下列有机物的分子结构。
乙烯的电子式__________,
乙烷的分子式________,
乙醇的结构式___________,
氯乙烷的结构简式________。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②_______________________,反应类型_______________。
④_______________________,反应类型_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+![]() O2(g)===H2O(g)的能量变化如图所示,a、b、c表示能量变化,为正值,单位为kJ,下列说法正确的是( )
O2(g)===H2O(g)的能量变化如图所示,a、b、c表示能量变化,为正值,单位为kJ,下列说法正确的是( )

A. H2(g)+![]() O2(g)===H2O(g) ΔH=c kJ·mol-1
O2(g)===H2O(g) ΔH=c kJ·mol-1
B. 2H2O(g)===2H2(g)+O2(g) ΔH=-2(a-b)kJ·mol-1
C. 1 mol氢气与0.5 mol氧气总能量为a kJ
D. 2 mol氢气与1 mol氧气完全反应生成2 mol液态水放出的热量小于2(b-a) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常用烧碱来清洗抽油烟机上的油渍(主要成分是油脂),下列说法不正确的是
A. 油脂属于天然高分子化合物
B. 热的烧碱溶液去油渍效果更好
C. 清洗时,油脂在碱性条件下发生水解反应
D. 烧碱具有强腐蚀性,故清洗时必须戴防护手套
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016上海卷】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
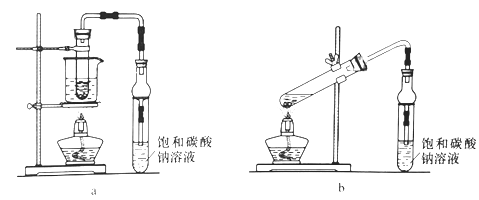
完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是___________、_____________、_____________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com