
| 103ρω |
| M |
| 1000×1.178×25% |
| 98 |
| 1.35g |
| 27g/mol |
| 1 |
| 3 |
| 2 |
| 3 |
| 103ρω |
| M |
| 1000×1.178×25% |
| 98 |
| 1.35g |
| 27g/mol |
| 1 |
| 3 |
| 2 |
| 3 |
| 3mol×0.05mol |
| 2mol |
| 0.05mol |
| 0.25L |
| 1 |
| 10 |
| 1 |
| 10 |
| 3mol×0.005mol |
| 1mol×0.5mol |


科目:高中化学 来源: 题型:
| 实验步骤和操作 | 实验现象 | 结论(-OH上氢原子活动性顺序) |
| (1)五种物质各取少量于五支试管中,各加入紫色石蕊试液2~3滴 | ②④变红,其它不变 | ②、④>①、③、⑤ |
| (2) | ||
| (3)①、③、⑤各取少量于试管中,各加入少量NaOH溶液 | ⑤由浑浊变澄清 | ⑤>①、③ |
| (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a<b |
| C、a=b | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、直径介于1~10nm之间的微粒称为胶体 |
| B、NaOH溶液中滴加FeCl3溶液制得Fe(OH)3胶体 |
| C、利用丁达尔效应可以区别溶液与胶体 |
| D、过滤可以分离胶体粒子与溶液中的溶质粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| n(CIO-) | ||
n(CI
|
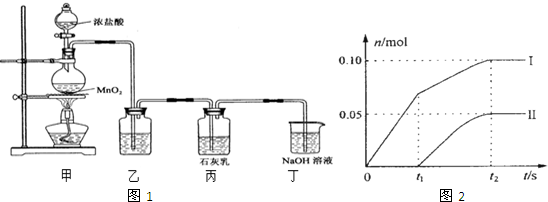
查看答案和解析>>
科目:高中化学 来源: 题型:
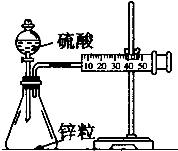 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 750C | 一 | 一 | 1mL | 100s |
| 2 | 750C | 10滴 | 一 | 1mL | 40s |
| 3 | 750C | 10滴 | 加入少许 | 1mL | 3s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积(mL) | 50 | 120 | 224 | 392 | 472 | 502 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,应立即用大量的水冲洗 |
| C、加热试管或烧杯时,应首先擦干外壁上的水 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com