
����Ŀ���ס��ҡ������ֻ���������⡢��������ͭ����Ԫ���е�������ɡ������£�����һ�ֺ�����������Ϊ87.5%��Һ̬���������Է��������������ij����Ҫ�ɷֵ���Է���������ȣ��Һͱ���ͭ�����ֳ����������������������ͭ����ȩ��Ӧ�Ļ�ԭ����Իش��������⣺
��1���Ľṹʽ ��
��2������һ�ֶ�Ԫ��������������ᷴӦ�IJ���Ϊ (д��ѧʽ)��
��3���ͱ���Ӧ�IJ����к����Һ�һ����̬���ʣ�д���仯ѧ����ʽ ��
��4�����ҵĹ����м�����������ữ����������Һ���ҹ�����ȫ�ܽ⣬�õ�����Һ��д�������ӷ���ʽ ��
���𰸡���1��![]() ����2��N2H6SO4 ����3��N2H4+4CuO==2Cu2O+N2+2H2O����4����2Fe3++Cu2O+2H+=2Fe2++2Cu2++H2O��
����2��N2H6SO4 ����3��N2H4+4CuO==2Cu2O+N2+2H2O����4����2Fe3++Cu2O+2H+=2Fe2++2Cu2++H2O��
��������
�����������1����������Ҫ�ɷ��ǵ�������������������ֱ�Ϊ28��32����˼������г�N����һ��Ԫ��Ӧ���⣬ϵ����ֵΪ87.5%/14��12.5%/1=1��2�������ʽNH2������Ƿ�����Ϊ28�������ϣ�������Ϊ32����ΪN2H4����ṹʽ��![]() ����2�����NaH4�Ƕ�Ԫ�N2H4��H2SO4=N2H6SO4����3���ס�����ͭ���ֳ��������������������������ͭ����ȩ�ĵĻ�ԭ�������ΪCu2O����ΪCuO��N2H4��CuO��Ӧ�õ�Cu2O��ͭ�Ļ��ϼ۽��ͣ���N�Ļ��ϼ����ߣ���̬����ΪN2����Ӧ����ʽΪN2H4��4CuO=2Cu2O��N2����2H2O����4��Cu2O��Cu���л�ԭ�ԣ�Fe3�����������ԣ����߷���������ԭ��Ӧ��2Fe3����Cu2O��2H��=2Fe2����2Cu2����H2O��
����2�����NaH4�Ƕ�Ԫ�N2H4��H2SO4=N2H6SO4����3���ס�����ͭ���ֳ��������������������������ͭ����ȩ�ĵĻ�ԭ�������ΪCu2O����ΪCuO��N2H4��CuO��Ӧ�õ�Cu2O��ͭ�Ļ��ϼ۽��ͣ���N�Ļ��ϼ����ߣ���̬����ΪN2����Ӧ����ʽΪN2H4��4CuO=2Cu2O��N2����2H2O����4��Cu2O��Cu���л�ԭ�ԣ�Fe3�����������ԣ����߷���������ԭ��Ӧ��2Fe3����Cu2O��2H��=2Fe2����2Cu2����H2O��


 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�е����ӷ�Ӧ�������м���˵����������ȷ����
A����������������ԭ��Ӧ B��ֻ���Ǹ��ֽⷴӦ
C�������ǻ��Ϸ�Ӧ D�����������û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ�������ڿ����л�Ϳ����е�ˮ������CO2��O2���ò��������⡱���á����⡱�׳ơ�ͭ�̡����ֳơ���ȸʯ��[��ѧʽΪCu2(OH��2CO3]����ͭ�̡��ܸ��ᷴӦ����ͭ�κ�CO2��H2O��ijͬѧ��������ϵ�з�Ӧʵ���ˡ�ͭ��ͭ�̡�������ͭ����ת����
![]()
��1�������ֲ�ͬ������ش�����ͭ�̡������������ʣ� _��
��2����д��ͭ�������ᷴӦ�Ļ�ѧ����ʽ�� ��
��3��д��B�Ļ�ѧʽ ��
��4������ת�����������ڻ��Ϸ�Ӧ���� �����ڸ��ֽⷴӦ���� (���������
��5��д���ٷ�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������̵���Ҫ������ͳ��õ��������������ǹ�ҵ�������̿��Ʊ�������ص�һ�ֹ���������

�� KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ�������� �������ơ�
A��75%�ƾ� B��˫��ˮ C������ D����84������Һ��NaClO��Һ��
�� ��������NaBiO3��������ˮ�����ڶ��Լ���������Һ��Mn2+�Ĵ�������Ԫ�صĻ�ԭ����ΪBi3+��Mn����������Ϊ+7������д����Ӧ�����ӷ���ʽ�� ��
�� д��MnO2��KOH�����ڻ������ͨ�����ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽ�� ��
�� ��K2MnO4��Һ��ͨ��CO2���Ʊ�KMnO4���÷�Ӧ�еĻ�ԭ���� ��
�� ���������п���ѭ��ʹ�õ�������ʯ�ҡ�CO2�� �� ��д��ѧʽ����
�� ������������ѭ�����Ʊ������е���ʧ����1mol MnO2���Ƶ� mol KMnO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д�����и��л���Ľṹ��ʽ��
��1����Է�������Ϊ114�������ף��������κ���̼ͬԭ������ϩ����H2�õ�����Ľṹ��ʽΪ____________��
��2����֪������A�뻯����B ��ת����ϵΪ��A![]() B���һ�����B�н���4��̼ԭ�ӡ�1����ԭ�ӡ�1����ԭ�ӣ���B�Ľṹ��ʽΪ____________��
B���һ�����B�н���4��̼ԭ�ӡ�1����ԭ�ӡ�1����ԭ�ӣ���B�Ľṹ��ʽΪ____________��
��3��ij��B����ʽΪCnH2n��2��������KMnO4��Һ������õ���
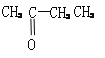 ��
��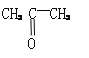 ��
��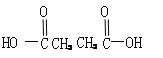
������Ľṹ��ʽΪ____________��
��4��ij��A����Է�������Ϊ84���ú�����ײ�֪�����к���̼̼˫�����ú˴Ź������������ʾֻ��һ�����͵���ԭ�ӡ���A�Ľṹ��ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ�����ȷ���� ��������
A. Cu��OH��2������ˮ�����ڷǵ����
B. SO2����Ӧ�����κ�ˮ����������������
C. NH4Cl����в����������ӣ���������
D. HCl��������ˮ�����H����Cl�����������ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ����о��õ���Ƭ5.0gͶ��ʢ��50mL0.1molL-1������Һ���ձ���,����Ƭ�����ᷴӦ����������������v(H2)�뷴Ӧʱ��t�Ĺ�ϵ��������ͼ��ʾ��������������ʾ���������۴������
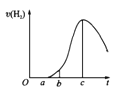
A��O��a�β�������������Ϊ��������������������ϡ����
B��b��c�β����������������ӽϿ����Ҫԭ��֮һ���¶�����
C��t=cʱ�̣���Ӧ����ƽ��
D��t��cʱ���������������ʽ��͵���Ҫԭ������Һ��H��Ũ���½�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п�����Ҫ�ɷ�ΪZnS,��������PbS��CuS��FeS��SiO2�ȣ�����п���Ʊ��Ȼ�п��������ͼ��ʾ��

��ش��������⣺
��1�������Ȼ�������ҺʱҪ��pHΪ0��8~1֮�䣬pH̫���� ��pH̫�ͣ����տ�ʯ������к����� ���������� �����Ȼ�п��Һ�Ʊ��Ȼ�п����ķ����� ��
��2���߷е��ܼ�R��4E����������ˮ��120��ʱ����R��4E����ܽ��Ϊ365g������ʱ�ܽ��Ϊ35��9g���ӽ���ҺB��ȡ��ķ����� �����ǹ�ҵ�Ʊ������ԭ�ϣ�����1�ֿ�ʯ������ܺ���Ϊ24%������Ʊ�Ũ��98%������ �֡�
��3���Ȼ�������п������Ӧ��![]() �����Ȼ�����FeS��Ӧ�ķ���ʽΪ ��
�����Ȼ�����FeS��Ӧ�ķ���ʽΪ ��
��4����ҺX�ijɷֵĻ�ѧʽΪ ����������ѭ��ʹ�õ������� ��
��5�����Ȼ�������Һ�Ʊ��Ȼ�����Һ��������![]() ��
��![]() ���������ɱ��ߡ����������£�ʹ�ô�����50������ͨ������ת���ijɱ����ͣ���Ӧ�����ӷ���ʽΪ ��
���������ɱ��ߡ����������£�ʹ�ô�����50������ͨ������ת���ijɱ����ͣ���Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
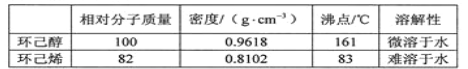
����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�
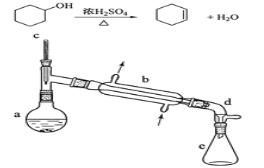
�����õ����й��������£�
�ϳɷ�Ӧ��
��a�м���20g��������2СƬ���Ƭ����ȴ��������������1 mLŨ���ᡣB��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�档
�����ᴿ��
��Ӧ�ֲ��ﵹ���Һ©���зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ơ�����ͨ������õ���������ϩ10g��
�ش��������⣺
��1��װ��b�������� ��
��2���������Ƭ�������� ���������һ��ʱ��������Ǽ����Ƭ��Ӧ�ò�ȡ����ȷ����ʱ ������ȷ�𰸱�ţ���
A���������� B����ȴ�� C�����貹�� D����������
��3����ʵ���������ײ����ĸ�����Ľṹ��ʽΪ ��
��4����Һ©����ʹ��ǰ����ϴ�ɾ��� ���ڱ�ʵ���������У�����Ӧ�ôӷ�Һ©���� ����Ͽڵ��������¿ڷų�������
��5�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ���� ��
��6���ڻ���ϩ�ֲ�����������У��������õ��������� ������ȷ�𰸱�ţ���
A��������ƿ
B���¶ȼ�
C������ƿ
D������������
E��������
��7����ʵ�����õ��Ļ���ϩ������ ������ȷ�𰸱�ţ���
A��41% B��50% C��61% D��70%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com